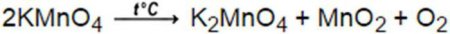Кисень: хімічні властивості елемента
Одним з найважливіших елементів на нашій планеті є кисень. Хімічні властивості цієї речовини дозволяють йому брати участь в біологічних процесах, а підвищена активність робить кисень впливовим учасником всіх відомих хімічних реакцій. У вільному стані ця речовина є в атмосфері. У зв'язаному стані кисень входить до складу мінералів, гірських порід, складних речовин, з яких складаються різні живі організми. Загальна кількість кисню на Землі оцінюється в 47% загальної маси нашої планети.

Вся маса природного кисню є сумішшю трьох ізотопів – 16 О, 17 О, 18 О. Процентне зміст цих ізотопів в загальній масі кисню одно 9976%, 004% та 02% відповідно. Етиловий спирт і багато гази стають твердими предметами, ртуть набуває твердість і ковкість, а гумовий м'ячик втрачає свою пружність і розсипається при найменшому ударі.
Етиловий спирт і багато гази стають твердими предметами, ртуть набуває твердість і ковкість, а гумовий м'ячик втрачає свою пружність і розсипається при найменшому ударі.
Кисень розчиняється у воді, хоча і в невеликих кількостях – морська вода містить 3-5% кисню. Але навіть невелика кількість цього газу поклало початок існуванню риб, молюсків та різних морських організмів, які отримують кисень з води для підтримки процесів власного життєзабезпечення.
Позначення кисню
У періодичній системі кисень займає восьму клітинку таблиці. Його міжнародна назва oxigenium. У хімічних записах він позначається латинською літерою «О». У природному середовищі атомарний кисень не зустрічається, його частинки з'єднуються, утворюючи парні молекули газу, молекулярна маса якого дорівнює 32 г/моль.Повітря і кисень
Повітря являє суміш декількох поширених на Землі газів. Найбільше в повітряній масі азоту - 782% за обсягом і 755 % по масі. Кисень займає лише друге місце за обсягом - 209%, а за масою - 232%. Третє місце закріплене за благородними газами. Решта домішки – вуглекислий газ, водяна пара, пил і інше – займають лише частки відсотка в загальній повітряній масі.
Вся маса природного кисню є сумішшю трьох ізотопів – 16 О, 17 О, 18 О. Процентне зміст цих ізотопів в загальній масі кисню одно 9976%, 004% та 02% відповідно.
Фізичні та хімічні властивості кисню
Один літр повітря при нормальних умовах важить 1293 р. При зниженні температури до -140?З повітря стає безбарвною прозорою рідиною. Незважаючи на низьку температуру кипіння повітря можна зберігати в рідкому стані навіть при кімнатній температурі. Для цього рідину потрібно помістити в так званий посудину Дьюара. Занурення в рідкий кисень докорінно змінює звичайні властивості предметів.
Кисень розчиняється у воді, хоча і в невеликих кількостях – морська вода містить 3-5% кисню. Але навіть невелика кількість цього газу поклало початок існуванню риб, молюсків та різних морських організмів, які отримують кисень з води для підтримки процесів власного життєзабезпечення.
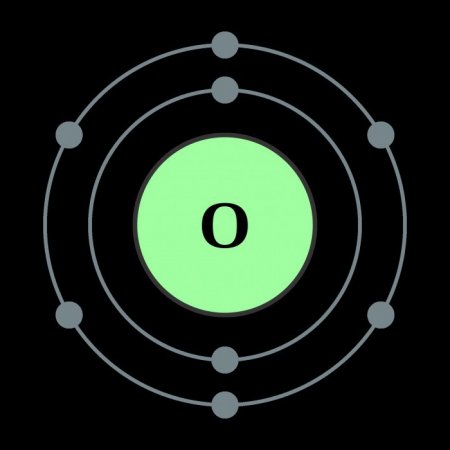
Будова атома кисню
Описані властивості кисню в першу чергу пояснюються внутрішньою будовою цього елемента. Кисень належить до головної підгрупи шостої групи елементів періодичної системи. У зовнішньому електронному хмарі елемента знаходяться шість електронів, чотири з яких займають p-орбіталі, а два останні розташовуються на s-орбіталях. Таке внутрішнє будова обумовлює великі енергетичні витрати, спрямовані на розривання електронних зв'язків – атому кисню простіше запозичувати два відсутніх електрона на зовнішню орбіталь, чим віддати свої шість. Тому ковалентность кисню у більшості випадків дорівнює двом. Завдяки двом вільним електронам кисень легко утворює двоатомні молекули, які характеризуються високою міцністю зв'язку. Лише при додається енергії понад 498 Дж/моль молекули розпадаються, і утворюється атомарний кисень. Хімічні властивості елементу дозволяють йому вступати в реакції з усіма відомими речовинами, виключаючи гелій, неон і аргон. Швидкість взаємодії залежить від температури реакції і від природи речовини.Хімічні властивості кисню
З різними речовинами кисень вступає в реакції утворення оксидів, причому ці реакції характерні для металів, і для неметалів. З'єднання кисню з металами називають основними оксидами – класичним прикладом служить оксид магнію, оксид кальцію. Взаємодія оксидів металів з водою призводить до утворення гідроксидів, що підтверджують активні хімічні властивості кисню. З неметалами це речовина утворює кислотні оксиди – наприклад, триоксид сірки SO 3. При взаємодії цього елемента з водою виходить сірчана кислота.Хімічна активність
З переважною більшістю елементів кисень взаємодіє безпосередньо. Виняток складають золото, галогени і платина. Взаємодія кисню з деякими речовинами значно прискорюється при наявності каталізаторів. Наприклад, суміш водню і кисню в присутності платини, що вступає в реакцію навіть при кімнатній температурі. З оглушливим вибухом суміш перетворюється в звичайну воду, важливою складовою частиною якої є кисень. Хімічні властивості та висока активність елемента пояснюють виділення великої кількості світла і тепла, тому хімічні реакції з киснем часто називаються горінням. Горіння в чистому кисні відбувається набагато інтенсивніше, ніж у повітрі, хоча кількість теплоти, що виділяється при реакції, буде приблизно однаковим, але процес через відсутність азоту протікає набагато швидше, а температура горіння стає вище.Отримання кисню
У 1774 році англійський вчений Д. Прістлі виділив невідомий газ з реакції розкладання оксиду ртуті. Але вчений не пов'язав виділений газ з уже відомим речовиною, що входить до складу повітря. Лише кілька років тому великий Лавуазьє вивчив фізико-хімічні властивості кисню, отриманого в даній реакції, і довів його ідентичність з газом, що входять до складу повітря. У сучасному світі кисень одержують з повітря. В лабораторіях використовую промисловий кисень, який поставляється балонами під тиском близько 15 Мпа. Чистий кисень можна одержати і в лабораторних умовах, стандартним способом його отримання є термічне розкладання перманганату калію, яке протікає за формулою:Отримання озону
Якщо через кисень або повітря пропустити струм, то в атмосфері з'явиться характерний запах, що передвіщає появу нової речовини – озону. Озон можна отримати і з хімічно чистого кисню. Утворення цієї речовини можна виразити формулою: 3О 2 = 2О 3 Ця реакція протікати самостійно не може – для її успішного завершення необхідна зовнішня енергія. Зате зворотне перетворення озону в кисень відбувається мимовільно. Хімічні властивості кисню й озону різняться в чому. Озон відрізняється від кисню щільністю, температурою плавлення і кипіння. При нормальних умовах цей газ має блакитний колір і володіє характерним запахом. Озон володіє більшою електропровідністю і краще розчиняється у воді, ніж кисень. Хімічні властивості озону пояснюються процесом його розпаду – при розкладанні молекули цієї речовини утворюється двухатомная молекула кисню плюс один вільний атом цього елемента, який агресивно реагує з іншими речовинами. Наприклад, відома реакція взаємодії озону і кисню: 6Ag+O 3 =3Ag 2 O А ось звичайний кисень не з'єднується з сріблом навіть при високій температурі. У природі активний розпад озону може спричинити утворення так званих озонових дір, які піддають загрозі життєві процеси на нашій планеті.Читайте також

НАУКА
Що таке азот? Маса азоту. Молекула азоту
НАУКА
Оксид азоту: формула, властивості, застосування

НАУКА
Діоксид вуглецю: формула, властивості та області застосування
НАУКА
Альдегіди: хімічні властивості, одержання, будова

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Темнова і світлова фаза фотосинтезу. Де протікає світлова фаза фотосинтезу?

НАУКА
Оксид барію: отримання і застосування
НАУКА
Молекулярна будова речовини