Що таке азот? Маса азоту. Молекула азоту
Неметалевий елемент 15-ї групи[Va]періодичної таблиці – азот, 2 атоми якого, з'єднуючись, утворюють молекулу, – безбарвний, без запаху і смаку газ, що становить велику частину атмосфери Землі і є складовою частиною всього живого.
Азот також зустрічається в мінеральних відкладах нітрату калію і натрію, а для задоволення потреб людини їх недостатньо. Іншим матеріалом, багатих цим елементом, є гуано, яке можна знайти в печерах, де багато кажанів, або в сухих місцях, відвідуваних птахами. Також азот міститься в дощ і грунті у вигляді аміаку і солей амонію, а в морській воді у вигляді іонів амонію (NH 4 + ), нітритів (NO 2 - ) і нітратів (NO 3 - ). У середньому він становить близько 16 % складних органічних сполук, таких як білки, присутні у всіх живих організмах. Природне його вміст в земній корі становить 03 частини на 1000. Поширеність в космосі – від 3 до 7 атомів на атом кремнію. Найбільшими країнами-виробниками азоту у вигляді аміаку) на початку XXI століття були Індія, Росія, США, Тринідад і Тобаго, Україна.
NH 4 + +NO 2 - ->N 2 +2H 2 O. 8NH 3 +3Br 2 ->N 2 +6NH 4 + +6Br - . 2NH 3 +3CuO->N 2 +3H 2 O+3Cu. Елементарний азот може бути використаний в якості інертної атмосфери для реакцій, що потребують виключення кисню і вологи. Знаходить застосування і рідкий азот. Водень, метан, окис вуглецю, фтор і кисень – єдині речовини, які при температурі кипіння азоту не переходять в твердий кристалічний стан. У хімічній промисловості цей хімічний елемент використовується для запобігання окислення або іншого псування продукту, як інертний розчинник хімічно активного газу, для видалення тепла або хімічних речовин, а також в якості інгібітора пожежі або вибуху. У харчовій промисловості газ азот застосовується для запобігання псування продуктів, а рідкий – для сушіння заморожуванням і в системах охолодження. В електротехнічній промисловості газ запобігає окисленню та інші хімічні реакції, створює тиск в оболонці кабелю і захищає електродвигуни. В металургії азот використовується при зварюванні і паянні, запобігаючи окислення, обуглероживание і зневуглецювання. Як неактивний газ його застосовують у виробництві пористої гуми, пластмаси і еластомерів, що він служить в якості пропеллента в аерозольних балончиках, а також створює тиск рідкого палива в реактивних літаках. У медицині швидке заморожування рідким азотом використовується для збереження крові, кісткового мозку, тканин, бактерій і сперми. Він знайшов застосування і в кріогенних дослідженнях.
Атомний номер: 7. Атомна маса азоту: 140067. Температура плавлення: -20986 °C. Точка кипіння: -1958 °C. Щільність (1 атм, 0 °С): 12506 г азоту на літр. Звичайні стану окислення: -3 +3 +5. Конфігурація електронів: 1s 2 2s 2 2p 3 .
Історія виявлення
Газ азот становить близько 4/5 земної атмосфери. Він був виділений в ході ранніх досліджень повітря. У 1772 році шведський хімік Карл Вільгельм Шеле першим продемонстрував, що таке азот. На його думку, повітря являє собою суміш двох газів, одне з яких він назвав «вогненним повітрям», т. к. той підтримував горіння, а інший – «нечистим повітрям», тому що він залишався після того, як перший витрачався. Це були кисень і азот. Приблизно в той же час азот був виділений шотландським ботаніком Даніелем Резерфордом, який першим опублікував свої висновки, а також британським хіміком Генрі Кавендішем і британським священнослужителем і вченим Джозефом Прістлі, який розділив з Шеєле першість відкриття кисню. Подальші дослідження показали, що новий газ входить до складу селітри, або нітрату калію (KNO 3 ), і, відповідно, він був названий нитрогеном ("народжує селітру") французьким хіміком Шапталем в 1790 р. вперше Азот був віднесений до хімічних елементів Лавуазье, чиє пояснення ролі кисню в горінні спростувало теорію флогистона – популярний у XVIII ст. помилкове уявлення про горінні. Нездатність цього хімічного елемента підтримувати життя (по-грецьки ???) стала причиною того, що Лавуазьє назвав газ азотом.Виникнення і поширення
Що таке азот? По поширеності хімічних елементів, він займає шосте місце. Атмосфера Землі на 7551 % за вагою і на 7809 % по об'єму складається з цього елемента і є основним його джерелом для промисловості. В атмосфері також міститься невелика кількість аміаку і солей амонію, а також оксиди азоту і азотна кислота, які утворюються під час гроз, а також у двигунах внутрішнього згоряння. Вільний азот знайдений у багатьох метеоритах, вулканічних і шахтних газах і деяких мінеральних джерелах, на сонце, зірки і туманностях.Азот також зустрічається в мінеральних відкладах нітрату калію і натрію, а для задоволення потреб людини їх недостатньо. Іншим матеріалом, багатих цим елементом, є гуано, яке можна знайти в печерах, де багато кажанів, або в сухих місцях, відвідуваних птахами. Також азот міститься в дощ і грунті у вигляді аміаку і солей амонію, а в морській воді у вигляді іонів амонію (NH 4 + ), нітритів (NO 2 - ) і нітратів (NO 3 - ). У середньому він становить близько 16 % складних органічних сполук, таких як білки, присутні у всіх живих організмах. Природне його вміст в земній корі становить 03 частини на 1000. Поширеність в космосі – від 3 до 7 атомів на атом кремнію. Найбільшими країнами-виробниками азоту у вигляді аміаку) на початку XXI століття були Індія, Росія, США, Тринідад і Тобаго, Україна.
Комерційне виробництво і використання
Промислове виробництво азоту засноване на фракційній перегонці зрідженого повітря. Температура його кипіння дорівнює -1958 °С, що на 13 °С нижче, ніж у кисню, який таким чином відокремлюється. Азот також може бути отриманий у великих масштабах шляхом спалювання вуглецю або вуглеводнів в повітрі і відділення отриманого діоксиду вуглецю і води з залишкового азоту. У малих масштабах чистий азот проводиться шляхом нагрівання азиду барію Ba(N 3 ) 2 . Лабораторні реакції включають нагрівання розчину нітриту амонію (NH 4 NO 2 ), окислення аміаку водним розчином брому або нагрітим оксидом міді:З'єднання
Більша частина азоту використовується у виробництві хімічних сполук. Потрійний зв'язок між атомами елемента настільки сильна (226 ккал на міль, вдвічі більше, ніж у молекулярного водню), що молекула азоту з працею вступає в інші з'єднання. Основним промисловим методом фіксації елемента є процес Хабера-Боша для синтезу аміаку, розроблений під час Першої світової війни, щоб зменшити залежність Німеччини від чилійської селітри. Він включає прямий синтез NH 3 – безбарвного газу з різким, дратівливим запахом – безпосередньо з його елементів. Велика частина аміаку перетворюється в азотну кислоту (HNO 3 ) та нітрати – солі та складні ефіри азотної кислоти, кальциновану соду (Na 2 CO 3 ), гідразин (N 2 H 4 ) – безбарвну рідину, яку використовують в якості ракетного палива і в багатьох промислових процесах. Азотна кислота є іншим основним комерційним з'єднанням даного хімічного елемента. Безбарвна, висококоррозионная рідина використовується у виробництві добрив, барвників, лікарських засобів та вибухових речовин. Нітрат амонію (NH 4 NO 3 ) – сіль аміаку і азотної кислоти – є найбільш поширеним компонентом азотних добрив.Азот + кисень
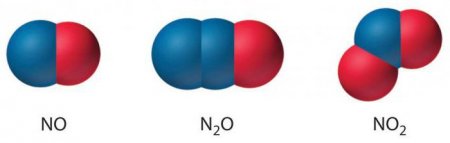
З киснем азот утворює ряд оксидів, у т. ч. закис азоту (N 2 O), в якій його валентність дорівнює +1 окис (NO) (+2) і двоокис (NO 2 ) (+4). Багато оксиди азоту надзвичайно летких; вони є головними джерелами забруднення в атмосфері. Закис азоту, також відома як звеселяючий газ, іноді використовується в якості анестезуючого засобу. При вдиханні вона викликає м'яку істерію. Оксид азоту швидко реагує з киснем з утворенням коричневого діоксиду, проміжного продукту у виробництві азотної кислоти і потужного окислювача в хімічних процесах і ракетному паливі. Також використовуються деякі нітриди, утворені сполученням металів з азотом при підвищених температурах. Нітрид бору, титану, цирконію і танталу мають спеціальні застосування. Одна кристалічна форма нітриду бору (BN), наприклад, по твердості не поступається алмазу і погано окислюється, тому використовується в якості високотемпературного абразиву. Неорганічні ціаніди містять групу CN - . Ціаністий водень, або синильна кислота HCN, є вкрай нестійким і надзвичайно токсичним газом, який застосовується для фумігації, концентрації руди, в інших промислових процесах. Дициан (CN) 2 використовується в якості проміжного хімічної речовини і для фумігації. Азиди представляють собою сполуки, які містять групи з трьох атомів азоту -N 3 . Більшість їх нестійкий і дуже чутлива до ударів. Деякі з них, такі, як азид свинцю Pb(N 3 ) 2 використовуються у детонаторах і капсулях. Азиди, подібно галогенам, охоче взаємодіють з іншими речовинами і утворюють безліч з'єднань. Азот входить до складу декількох тисяч органічних сполук. Більшість з них є похідними від аміаку, ціаністого водню, ціану, закису або азотної кислоти. Аміни, амінокислоти, аміди, наприклад, отримані з аміаку або тісно пов'язані з ним. Нітрогліцерин і нітроцелюлоза – складні ефіри азотної кислоти. Нітрити отримують з азотистої кислоти (HNO 2 ). Пурини і алкалоїди є гетероциклічними сполуками, в яких азот заміщає один або кілька атомів вуглецю.Властивості та реакції
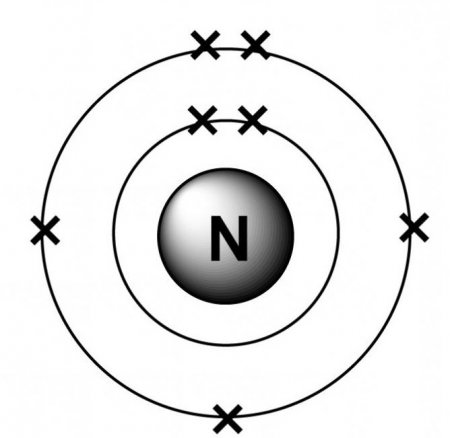
Що таке азот? Це безбарвний газ без запаху, що конденсується при -1958 °С в безбарвну, маловязкую рідина. Елемент існує у вигляді молекул N 2 , подаються у вигляді :N:::N:, у яких енергія зв'язку дорівнює 226 ккал на міль, поступається тільки окису вуглецю (256 ккал на моль). З цієї причини енергія активації молекулярного азоту дуже висока, тому в звичайних умовах елемент відносно інертний. Крім того, високостабильная молекула азоту в значній мірі сприяє термодинамічної нестійкості багатьох азотовмісних сполук, в яких зв'язки, нехай і досить сильні, але поступаються зв'язків молекулярного азоту. Відносно недавно і несподівано була відкрита здатність молекул азоту служити в якості лігандів в комплексних сполуках. Спостереження того, що деякі розчини комплексів рутенію можуть поглинати атмосферний азот, призвело до того, що незабаром може бути знайдений більш простий і кращий спосіб фіксації цього елемента. Активний азот можна отримати шляхом пропускання газу низького тиску через високовольтний електричний розряд. Продукт світиться жовтим світлом і набагато охочіше вступає в реакції, ніж молекулярний, з атомарним воднем, сіркою, фосфором і різними металами, а також здатний розкладати NO до N 2 і O 2 . Більш чітке уявлення про те, що таке азот, можна отримати завдяки його електронній структурі, яка має вигляд 1s 2 2s 2 2p 3 . П'ять електронів зовнішніх оболонок слабо екранують заряд, внаслідок чого ефективний ядерний заряд відчувається на відстані ковалентного радіуса. Атоми азоту відносно невеликі і мають високу електроотрицательностью, розташовуючись між вуглецем і киснем. Електронна конфігурація включає три напівзаповнені зовнішні орбіталі, що дозволяють утворювати три ковалентні зв'язки. Тому атом азоту повинен володіти надзвичайно високою реакційною здатністю, утворюючи з більшістю інших елементів стабільні бінарні сполуки, особливо коли інший елемент істотно відрізняється електроотрицательностью, надає значну полярність зв'язків. Коли електроотрицательность іншого елемента нижче, полярність надає атому азоту частковий негативний заряд, що звільняє його нерозділені електрони для участі в координаційних зв'язків. Коли інший елемент більш електроотрицателен, частково позитивний заряд азоту істотно обмежує донорні властивості молекули. При малій полярності зв'язку, внаслідок рівної електронегативність елемента, множинні зв'язки переважають над поодинокими. Якщо невідповідність атомних розмірів перешкоджає утворенню множинних зв'язків, то утворена проста зв'язок, ймовірно, буде відносно слабкою, і з'єднання буде нестійким.Аналітична хімія
Часто відсоток азоту в газовій суміші може бути визначений шляхом виміру її обсягу після поглинання інших компонентів хімічними реагентами. Розкладання нітратів сірчаною кислотою в присутності ртуті вивільняє окис азоту, яка може бути виміряна у вигляді газу. Азот вивільняється з органічних сполук, коли вони згорають над окисом міді, а вільний азот може бути виміряний у вигляді газу після поглинання інших продуктів згоряння. Добре відомий метод К'єльдаля за визначенням змісту розглянутого нами речовини в органічних сполуках полягає в розкладанні з'єднання концентрованої сірчаної кислотою (у разі необхідності містить ртуть, або її оксид, а також різні солі). Таким чином азот перетворюється в сульфат амонію. Додавання гідроксиду натрію вивільняє аміак, який збирають звичайної кислотою; залишкове кількість непрореагіровавшей кислоти потім визначається титруванням.Біологічне і фізіологічне значення
Роль азоту в живій матерії підтверджує фізіологічну активність його органічних сполук. Більшість живих організмів не може використовувати цей хімічний елемент безпосередньо і повинно мати доступ до його сполук. Тому фіксація азоту має величезне значення. У природі це відбувається в результаті двох основних процесів. Одним з них є дія електричної енергії на атмосферу, завдяки чому молекула азоту і кисню дисоціюють, що дозволяє вільним атомів утворити NO і NO 2 . Двоокис потім вступає в реакцію з водою: 3NO 2 +H 2 O->2HNO 3 +NO. HNO 3 розчиняється і приходить на Землю з дощем у вигляді слабкого розчину. З часом кислота стає частиною комбінованого азоту ґрунту, де нейтралізується, утворюючи нітрити і нітрати. Зміст N в культивованих грунтах, як правило, відновлюється завдяки внесенню добрив, що містять нітрати і амонійні солі. Виділення тварин і рослин і їх розкладання повертає сполуки азоту в ґрунт і повітря. Іншим основним процесом природної фіксації є життєдіяльність бобових. Завдяки симбіозу з бактеріями ці культури здатні перетворювати атмосферний азот безпосередньо в його сполуки. Деякі мікроорганізми, такі як Azotobacter Chroococcum і Clostridium pasteurianum, здатні фіксувати N самостійно. Сам газ, будучи інертним, нешкідливий, за винятком випадку, коли їм дихають під тиском, і він розчиняється в крові та інших рідинах тіла в більш високих концентраціях. Це викликає наркотичний ефект, а якщо тиск знижується дуже швидко, надлишок азоту виділяється у вигляді бульбашок газу в різних місцях організму. Це може викликати біль у м'язах і суглобах, непритомність, частковий параліч і навіть смерть. Ці симптоми називаються декомпресійної хвороби. Тому ті, хто змушений дихати повітрям в таких умовах, повинні дуже повільно знижувати тиск до нормального, щоб надлишок азоту виходив через легені без утворення бульбашок. Кращою альтернативою є використання для дихання суміші кисню та гелію. Гелій набагато менш розчинний у рідинах організму, і небезпека зменшується.Ізотопи
Азот існує у вигляді двох стабільних ізотопів: 14 N (9963 %) і 15 N (037 %). Вони можуть бути розділені за допомогою хімічного обміну або шляхом термічної дифузії. Маса азоту у вигляді штучних радіоактивних ізотопів знаходиться в межах 10-13 і 16-24. Найбільш стабільний період напіврозпаду, що дорівнює 10 хвилинам. Перша штучно індукована ядерна трансмутація була здійснена в 1919 р. британським фізиком Ернестом Резерфордом, який, бомбардуючи азот-14 альфа-частинками, отримав ядра кисню-17 і протони.Властивості
Наостанок наведемо основні властивості азоту:Читайте також

Сад Город
Загальна класифікація добрив, види та особливості застосування

НАУКА
Основні види газів
НАУКА
Оксид азоту: формула, властивості, застосування
НАУКА
Ступінь окислення азоту в амонії

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Солі амонію: властивості. Солі амонію: застосування
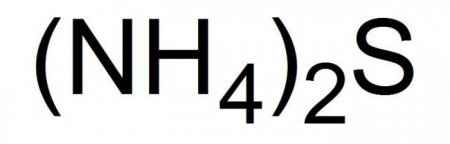
НАУКА
Сульфід амонію: отримання, гідроліз, застосування

НАУКА
Кисень: хімічні властивості елемента