Ідеальний газ і його визначення
Наука фізика відіграє важливу роль в вивченні навколишнього світу. Тому її поняття і закони починають проходити ще в школі. Властивості речовини вимірюються в різних аспектах. Якщо розглядати його агрегатний стан, то тут існує особлива методика. Ідеальний газ - це фізична концепція, яка дозволяє оцінити властивості і характеристики матеріалу, з якого складається весь наш світ.
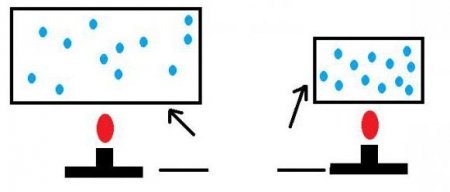
 Коли вони підлітають один до одного впритул і знаходяться на дуже малій відстані, вони сильно взаимоотталкиваются. Але на великій відстані між молекулами діють відносно невеликі сили тяжіння. Якщо ж середню відстань, на якій вони знаходяться один від одного, велике, це положення речовини називають розрідженим газом. Взаємодія таких частинок проявляється як рідкісні удари молекул. Це відбувається, лише коли вони підлітають впритул один до одного. В ідеальному ж газі взаємодія молекул не враховується взагалі. В ідеальному газі кількість молекул дуже велике. Тому обчислення відбуваються тільки за допомогою статистичного методу. Причому слід зазначити, що частинки речовини в такому випадку розподіляються в просторі рівномірно. Це найбільш часто зустрічається стан ідеального газу.
Коли вони підлітають один до одного впритул і знаходяться на дуже малій відстані, вони сильно взаимоотталкиваются. Але на великій відстані між молекулами діють відносно невеликі сили тяжіння. Якщо ж середню відстань, на якій вони знаходяться один від одного, велике, це положення речовини називають розрідженим газом. Взаємодія таких частинок проявляється як рідкісні удари молекул. Це відбувається, лише коли вони підлітають впритул один до одного. В ідеальному ж газі взаємодія молекул не враховується взагалі. В ідеальному газі кількість молекул дуже велике. Тому обчислення відбуваються тільки за допомогою статистичного методу. Причому слід зазначити, що частинки речовини в такому випадку розподіляються в просторі рівномірно. Це найбільш часто зустрічається стан ідеального газу.
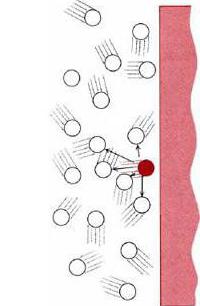
 Робота ідеального газу має такий вираз: p = 1 / 3 m 0 nv 2 , де p - тиск ідеального газу, m 0 - молекулярна маса, v 2 - середнє значення концентрації частинок, квадрат швидкості молекул. Якщо позначити середній показник кінетичного руху частинок речовини, як Ек = m 0 n/ 2 , то рівняння буде мати такий вигляд: p = 2 / 3 nEk. Молекули газу, вдаряючись об стінки посудини, вступають з ними у взаємодію як пружні тіла за законами механіки. Імпульс від таких ударів передається стінок посудини.
Робота ідеального газу має такий вираз: p = 1 / 3 m 0 nv 2 , де p - тиск ідеального газу, m 0 - молекулярна маса, v 2 - середнє значення концентрації частинок, квадрат швидкості молекул. Якщо позначити середній показник кінетичного руху частинок речовини, як Ек = m 0 n/ 2 , то рівняння буде мати такий вигляд: p = 2 / 3 nEk. Молекули газу, вдаряючись об стінки посудини, вступають з ними у взаємодію як пружні тіла за законами механіки. Імпульс від таких ударів передається стінок посудини.  Це загальноприйнята система. Таке значення температури названо абсолютним нулем. Провівши відповідні розрахунки, можна отримати відповідь, що значення цього показника становитиме -273 градуси за Цельсієм. Це підтверджує, що між абсолютною і шкалою Цельсія існує зв'язок. Її можна виразити в такому рівнянні: Т = t + 237. Слід зазначити, що досягти абсолютного нуля неможливо. Будь-охолоджувальний процес заснований на випаровуванні з поверхні молекул речовини. Наближаючись до абсолютного нуля, поступальний рух частинок так сильно сповільнюється, що випаровування припиняється зовсім. Але з чисто теоретичної точки зору якби було реально досягти точки абсолютного нуля, то швидкість руху молекул зменшилася настільки, що її можна було б назвати відсутньою зовсім. Тепловий рух молекул припинилося. Вивчивши таке поняття, як ідеальний газ, можна зрозуміти принцип роботи будь-якої речовини. Розширивши знання в цій області, можна зрозуміти властивості і поведінка якого газоподібного речовини.
Це загальноприйнята система. Таке значення температури названо абсолютним нулем. Провівши відповідні розрахунки, можна отримати відповідь, що значення цього показника становитиме -273 градуси за Цельсієм. Це підтверджує, що між абсолютною і шкалою Цельсія існує зв'язок. Її можна виразити в такому рівнянні: Т = t + 237. Слід зазначити, що досягти абсолютного нуля неможливо. Будь-охолоджувальний процес заснований на випаровуванні з поверхні молекул речовини. Наближаючись до абсолютного нуля, поступальний рух частинок так сильно сповільнюється, що випаровування припиняється зовсім. Але з чисто теоретичної точки зору якби було реально досягти точки абсолютного нуля, то швидкість руху молекул зменшилася настільки, що її можна було б назвати відсутньою зовсім. Тепловий рух молекул припинилося. Вивчивши таке поняття, як ідеальний газ, можна зрозуміти принцип роботи будь-якої речовини. Розширивши знання в цій області, можна зрозуміти властивості і поведінка якого газоподібного речовини.
Загальне визначення
Ідеальним газом названа модель, в якій взаємодією між молекулами прийнято нехтувати. Процес взаємодії частинок будь-якої речовини один з одним досить складний.
Коли газ можна вважати ідеальним
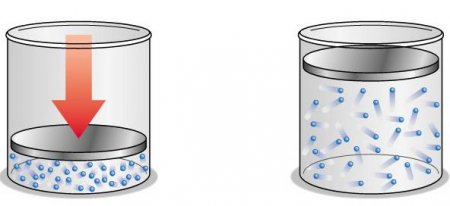
Існує декілька чинників, завдяки яким газ називається ідеальним. Першою ознакою є поведінка молекул як абсолютно пружних тіл, між ними відсутні сили тяжіння. При цьому газ буде дуже розряджений. Відстань між найменшими складовими речовини буде набагато більше розмірів їх самих. В такому випадку теплова рівновага буде досягатися миттєво по всьому об'єму. Щоб досягти стану ідеального газу в лабораторних умовах, реальний його тип розріджується відповідним чином. Деякі речовини в газоподібному стані навіть при кімнатній температурі і нормальному атмосферному тиску практично не відрізняються від ідеального стану.
Межі застосування моделі
Иеальний газ розглядається в залежності від поставлених завдань. Якщо перед дослідником поставлено завдання визначити залежність між температурою, об'ємом і тиском, ідеальним можна вважати такий стан речовини, при якому газу спостерігається висока точність до тисків, що вимірюються кількома десятками атмосфер. Але у випадку вивчення фазового переходу, наприклад, випаровування і конденсації, процесу досягнення рівноваги в газі, розглянуту модель не можна застосовувати навіть при дуже маленькому тиску. Тиск газу на стінку пробірки відбувається при хаотичному наголосі молекул об скло. Коли такі часті удари, організм людини може вловити ці зміни як безперервний вплив.Рівняння ідеального газу
Базуючись на головних принципах молекулярно-кінетичної теорії, було виведено головне рівняння ідеального газу.
Температура
Обчисливши тільки тиск газу на стінки посудини, можна визначити середній показник кінетичної енергії його частинок. Причому цього не можна зробити ні для окремої молекули, ні для їх концентрації. Тому для вимірювання параметрів газу необхідно визначати ще одну величину. Нею виступає температура, яка також пов'язана з кінетичною енергією молекул. Такий показник виступає скалярної фізичною величиною. Температура описує термодинамічна рівновага. В такому стані не відбувається зміна параметрів на мікрорівні. Температура вимірюється як відхилення від нульового значення. Вона характеризує насиченість хаотичного руху найменших частинок газу. Вона вимірюється середнім значенням їх кінетичної енергії. Визначається цей показник за допомогою термометрів в градусах різних відміток. Існує абсолютна термодинамічна шкала Кельвіна) та емпіричні її різновиди. Вони відрізняються початковими точками.Рівняння стану ідеального газу з урахуванням температури
Фізик, Больцман стверджує, що середній показник кінетичної енергії частинки пропорційний абсолютним показником температури. Ек = 3 / 2 кТ, де к = 138•10-23 Т - температура. Робота ідеального газу дорівнюватиме: Р = NkT/V, де N - кількість молекул, V - об'єм посудини. Якщо до цього показника додати концентрацію n = N/V, то вищенаведена формула буде мати такий вигляд: p = nkT. Ці два рівняння мають різні форми запису, але вони пов'язують для ідеального газу тиск, об'єм і температуру. Ці обчислення можна застосовувати як до чистих газів, так і до їх сумішей. В останньому варіанті під n потрібно розуміти все число молекул речовин, їх сумарну концентрацію або повне кількість молей в речовині.Три газових закону
Ідеальний газ і його приватні закони були відкриті експериментально і лише потім підтверджені теоретично. Перший приватний закон говорить, що ідеальний газ при постійній масі і температурі матиме назад пропорційне тиск його об'єму. Процес, при якому показник температури постійний, був названий ізотермічним. Якщо ж при дослідженні постійним є тиск, то обсяг пропорційний значенням абсолютної температури. Цей закон носить ім'я Гей-Люссака. Ізохорний процес відбувається при постійному обсязі. При цьому тиск буде пропорційно абсолютним температурі. Його назва - закон Шарля. Це три приватних закону поведінки ідеального газу. Їх вдалося підтвердити лише при оволодінні знаннями про молекулах.Абсолютна шкала вимірювання
В абсолютній шкалі вимірювання прийнято називати одиницею Кельвін. Вона обрана виходячи з популярної шкали Цельсія. Один Кельвін відповідає одному градусу за Цельсієм. Але в абсолютною шкалою за нуль прийнято значення, при якому тиск ідеального газу при постійному обсязі буде дорівнює нулю.
Читайте також

Дім
Дотискувальний компресор: опис, принцип роботи та характеристика

НАУКА
Насичений пар і його властивості

НАУКА
Досвід Штерна - експериментальне підтвердження теорії
НАУКА
Абсолютний тиск - формула та приклади розрахунків

Техніка
Холодильні машини і установки: пристрій і принцип роботи

НАУКА
В'язкість води. Кінематична в'язкість води. Динамічна в'язкість води

НАУКА
Молекулярна маса: базові принципи визначення
НАУКА
Молекулярна будова речовини