Молекулярна маса: базові принципи визначення
Молекулярна маса – одна з основних понять в сучасній хімії. Її введення став можливим після наукового обгрунтування твердження Авогадро про те, що багато речовини складаються з дрібних частинок – молекул, кожна з яких, у свою чергу, складається з атомів. Цим судженням наука багато в чому зобов'язана італійському хіміку Амедео Авогадро, який науково обґрунтував молекулярну будову речовин і подарував хімії багато найважливіші поняття та закони.

Температура 0°С. Тиск 1013 кПа. Для нормальних умов прийнято спеціальне скорочення – н. у. Іноді в задачах це позначення не пишеться, тоді слід уважно перечитати умови завдання і привести задані параметри газу до нормальних умов. V — об'єм газу; m — маса газу; ? — щільність газу. Отримаємо, що молярний об'єм азоту при нормальних умовах V(N 2 )= 25г/моль : 125 г/літр =224 л/моль. Виходить, що один моль азоту займає 224 літра. Якщо виконати таку операцію зі всіма існуючими газовими речовин, можна прийти до дивовижного висновку: обсяг будь-якого газу при нормальних умовах дорівнює 224 літра. Незалежно від того, про який газ йде мова, яка його структура і фізико-хімічні характеристики, один моль цього газу буде займати об'єм 224 літра. Молярний об'єм газу – одна з найважливіших констант в хімії. Ця постійна дозволяє вирішити багато хімічні задачі, зв'язані з виміром властивостей газів при нормальних умовах.

Одиниці мас елементів
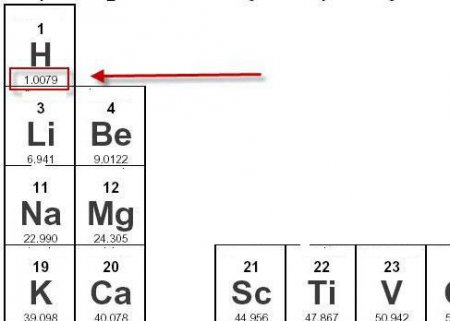
Спочатку за базову одиницю атомної і молекулярної маси брали атом водню як найбільш легкого з елементів у Всесвіті. Але атомні маси в більшості своїй обчислювалися але основі їх кисневих з'єднань, тому було прийнято рішення вибрати новий еталон для визначення атомних мас. Атомну масу кисню прийняли рівною 15 атомну масу самого легкого речовини на Землі, водню, - 1. У 1961 році киснева система визначення ваги була загальноприйнятою, але створювала певні незручності. В 1961 році була прийнята нова шкала відносних атомних мас, еталоном для якої став ізотоп вуглецю 12 С. Атомна одиниця маси (скорочено а.е.м.) становить 1/12 частина маси цього еталону. В даний час атомною масою називають масу атома, яка повинна бути виражена в а.е.м.Маса молекул
Маса молекула будь речовини дорівнює сумі мас усіх атомів, що утворюють дану молекулу. Найлегша молекулярна маса газу у водню, його з'єднання пишеться як Н 2 і має значення, наближене до двох. Молекула води складається з атома кисню і двох атомів водню. Значить, її молекулярна маса дорівнює 15994 + 2*10079=180152 а.е.м. Найбільші молекулярні маси мають складні органічні сполуки – білки і амінокислоти. Молекулярна маса структурної одиниці білка коливається від 600 до 10 6 і вище, залежно від кількості пептидних ланцюгів в цій макромолекулярної структури.
Моль
Одночасно зі стандартними одиницями маси та обсягу хімії використовується абсолютно особлива системна одиниця – моль. Моль – це кількість речовини, яка містить стільки структурних одиниць (іонів, атомів, молекул, електронів), стільки міститься в 12 грамах ізотопу 12 С. При застосуванні запобіжного кількості речовини необхідно вказувати, які саме структурні одиниці маються на увазі. Як випливає з поняття «моль», в кожному окремому випадку слід точно зазначати, про яких структурних одиницях йде мова – наприклад, моль іонів Н + , моль молекул Н 2 та інше.Молярна і молекулярна маса
Маса кількості речовини 1 моль вимірюється в г/моль і називається молярної масою. Відношення між молекулярною і молярної масою можна записати у вигляді рівняння ? = k x m/M, де до – коефіцієнт пропорційності. Неважко сказати, що для будь-яких співвідношень коефіцієнт пропорційності дорівнює одиниці. Дійсно, ізотоп вуглецю має відносну молекулярну масу 12.е.м, а, згідно з визначенням, молярна маса цієї речовини дорівнює 12 г/моль. Відношення молекулярної маси до молярної дорівнює 1. Звідси можна зробити висновок, що молярна і молекулярна маса мають однакові числові значення.Об'єми газів
Як відомо, всі оточуючі нас речовини можуть перебувати в твердому, рідкому або газоподібному агрегатному стані. Для твердих тіл найбільш поширеною базовою мірою є маса, для твердих і рідких – обсяг. Це пов'язано з тим, що тверді тіла зберігають свою форму і кінцеві розміри, Рідкі і газоподібні речовини кінцевих розмірів не мають. Особливість будь-якого газу полягає в тому, що між його структурними одиницями – молекулами, атомами, іонами - відстань у багато разів більше, ніж такі ж відстані в рідинах або твердих тілах. Наприклад, один моль води в нормальних умовах займає об'єм 18 мл – приблизно стільки ж вміщається в одну столову ложку. Об'єм одного моля дрібнокристалічної кухонної солі – 585 мл, а об'єм 1 моля цукру більше моля води у 20 разів. Для газів місця потрібно ще більше. Один моль азоту при нормальних умовах займає об'єм, в 1240 разів більший, ніж один моль води. Таким чином, обсяги газоподібних речовин істотно відрізняються від обсягів рідких і твердих. Це обумовлено різницею відстаней між молекулами речовин у різних агрегатних станах.Нормальні умови
Стан будь-якого газу сильно залежить від температури і тиску. Наприклад, азот при температурі 20 °С займає об'єм в 24 літри, а при 100 °С при тому самому тиску - 306 літрів. Хіміки врахували таку залежність, тому було прийнято рішення зводити всі операції та вимірювання з газоподібними речовинами до нормальних умов. У всьому світі параметри нормальних умов однакові. Для газоподібних хімічних речовин це:Розрахунок обсягу 1 моля газу
В якості прикладу нескладно виконати розрахунок одного моля будь-якого газу, наприклад азоту. Для цього спочатку потрібно знайти значення його відносної молекулярної маси: М r (N 2 )= 2x14=28. Оскільки відносна молекулярна маса речовини чисельно дорівнює молярної, то M(N 2 )=28 г/моль. Досвідченим шляхом з'ясовано, що при нормальних умовах щільність азоту дорівнює 125 г/літр. Підставимо це значення в стандартну формулу, відому зі шкільного курсу фізики, де:Підсумки
Молекулярна маса газоподібних речовин важлива для визначення кількості речовини. А якщо дослідник знає кількість речовини того або іншого газу, він може визначити масу або обсяг такого газу. Для однієї і тієї ж порції газоподібного речовини одночасно виконуються умови: ? = m/M ?= V/V m. Якщо прибрати постійну ?, можна зрівняти ці два вирази: m /M = V/V m. Так можна обчислити масу однієї порції речовини і його обсяг, а також стає відомою молекулярна маса досліджуваної речовини. Застосовуючи цю формулу, можна легко обчислити співвідношення об'єм-маса. При виконанні цієї формули до вигляду M= m V m /V стане відома молярна маса шуканого з'єднання. Для того щоб обчислити це значення, досить дізнатися масу і об'єм досліджуваного газу. Слід пам'ятати, що суворе відповідність реальної молекулярної маси речовини до тієї, що знайдена за формулою, неможливо. Будь газ містить масу домішок і добавок, які вносять певні зміни в його структуру і впливають на визначення його маси. Але ці коливання вносять зміни в третю або четверту цифру після коми в знайденому результаті. Тому для шкільних задач і експериментів знайдені результати цілком правдоподібні.Читайте також
НАУКА
Ступінь окислення азоту в амонії

НАУКА
Закон еквівалентів: формула і формулювання. Закон еквівалентів в хімії
НАУКА
Чому дорівнює молярна маса водню?

НАУКА
Кисень: хімічні властивості елемента

НАУКА
Ідеальний газ і його визначення
НАУКА
Абсолютний тиск - формула та приклади розрахунків

НАУКА
Скільки важить яйце куряче? Скільки важить варене куряче яйце?
НАУКА
Молекулярна будова речовини