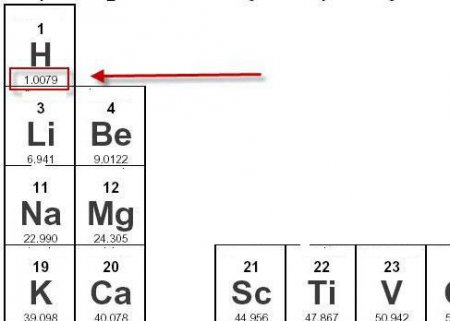
Чому дорівнює молярна маса водню?
Задачі з шкільного курсу хімії досить часто пропонують самостійно звертатися до довідників постійних величин. Так учні отримують навички самостійної роботи з довідковою літературою і вчаться отримувати інформацію з комбінованих джерел. Так, старшокласникам пропонується самостійно дізнатися, чому дорівнює молярна маса водню, або спробувати визначити її самостійно. Для рішення подібних задач необхідно чітко розуміти, що таке молярна маса, як вона визначається і для чого це потрібно.
Тому в хімії використовують відносну атомну масу. Її величина становить 1/12 маси атома вуглецю. У цій шкалою водень має найменший молекулярний вагу, так як його атом – найлегший серед всіх існуючих елементів.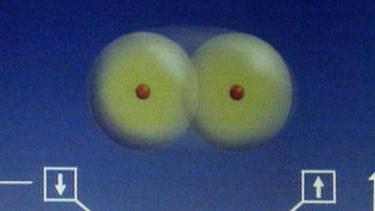
А в хімічних записах формула молекули водню має вигляд Н 2 . Знаючи формулу елемента, легко обчислити його відносну молекулярну (а значить, і молярную) масу. З отриманих даних легко обчислюється молярна маса водню: 100 x 2 = 200 г/моль. Точне хімічне зважування дає значення 2016 г/моль.
Визначення
Вперше поняття молярної маси було введено в обіг безпосередньо після визнання заходи «моль» як міра кількості речовини. Вимірюється ця величина в[г /моль]. Таким чином, молярна маса водню – це певна його маса, укладена в одному молі даного елемента. Оскільки в молях вимірюється кількість, виражена в кількості самих малих часток досліджуваного речовини, різниці між молекулярною і молярної масою немає. ці одиниці тотожні.Молекулярна і молярна маса водню
Абсолютними значеннями молекулярних мас, в силу їх надзвичайно малої величини, користуватися дуже важко. Наприклад, абсолютна маса атома водню, виражена в стандартах системи СІ, становить 167 x 10 -24 грам.Тому в хімії використовують відносну атомну масу. Її величина становить 1/12 маси атома вуглецю. У цій шкалою водень має найменший молекулярний вагу, так як його атом – найлегший серед всіх існуючих елементів.
Визначення молярної маси
Молярна маса водню може бути легко визначена за допомогою періодичної таблиці. Внизу біля кожного хімічного елемента позначена величина відносної атомної маси. Так, біля водню варто значення 10079. З курсу неорганічної хімії відомо, що водень в атомарному стані в природних умовах практично не зустрічається. Атоми цього елемента у вільному стані прагнуть об'єднатися в молекули. Оскільки валентність водню дорівнює 1 атом Н може приєднати до себе ще тільки один атом іншого елемента. Таким чином, молекула водню виглядає так:
А в хімічних записах формула молекули водню має вигляд Н 2 . Знаючи формулу елемента, легко обчислити його відносну молекулярну (а значить, і молярную) масу. З отриманих даних легко обчислюється молярна маса водню: 100 x 2 = 200 г/моль. Точне хімічне зважування дає значення 2016 г/моль.
Читайте також

Сад Город
Замочування насіння в перекису водню перед посадкою - як використовувати і розвести перекис?

НАУКА
Ступінь і константа гідролізу
НАУКА
Ковалентний полярний зв'язок: формула, властивості, особливості

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Закон еквівалентів: формула і формулювання. Закон еквівалентів в хімії

НАУКА
Кисень: хімічні властивості елемента

НАУКА
Молекулярна маса: базові принципи визначення
НАУКА
Молекулярна будова речовини