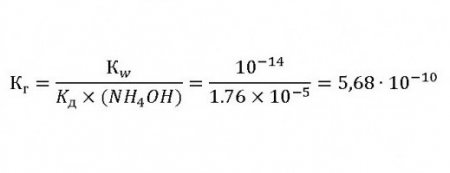Ступінь і константа гідролізу
Якщо розглядати дві головні галузі хімічної науки, неорганічну та органічну хімію, з'ясовується, що ви знайдете в них не так вже багато точок дотику. Але є один процес істинно глобального масштабу, який об'єднує неорганічні та органічні речовини. Це процес гідролізу.
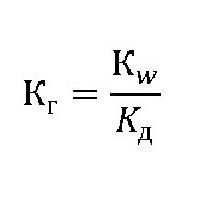 де: K w – іонний добуток води[H+]*[OH-]; K д – константа дисоціації (розщеплення) растворяемого речовини. Для органічних сполук ступінь і константа гідролізу пов'язані з формулою:
де: K w – іонний добуток води[H+]*[OH-]; K д – константа дисоціації (розщеплення) растворяемого речовини. Для органічних сполук ступінь і константа гідролізу пов'язані з формулою: 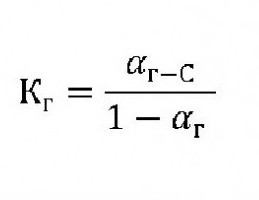 де: До р – константа гідролізу. З – концентрація іонів розчиненої речовини. ? р – ступінь гідролізу.
де: До р – константа гідролізу. З – концентрація іонів розчиненої речовини. ? р – ступінь гідролізу. 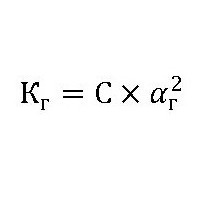 де: С – концентрація розчиненої речовини (моль/л). ? р – ступінь гідролізу, буде також залежати ще і від природи каталізатора (ферменту), його активності і від температури розчину. Наприклад, у технологічному процесі обмінних реакцій целюлози з водою фахівці прораховують всі параметри, головними з яких є константа гідролізу і константа швидкості гідролізу. Для останньої величини вводять такі складові, як: ?– відносну активність каталізатора, N – його нормальність, тобто концентрацію, b – здатність до гідролізу целюлози і ? – показник, що характеризує залежність швидкості реакції з водою від температури: k=?*N*b*?
де: С – концентрація розчиненої речовини (моль/л). ? р – ступінь гідролізу, буде також залежати ще і від природи каталізатора (ферменту), його активності і від температури розчину. Наприклад, у технологічному процесі обмінних реакцій целюлози з водою фахівці прораховують всі параметри, головними з яких є константа гідролізу і константа швидкості гідролізу. Для останньої величини вводять такі складові, як: ?– відносну активність каталізатора, N – його нормальність, тобто концентрацію, b – здатність до гідролізу целюлози і ? – показник, що характеризує залежність швидкості реакції з водою від температури: k=?*N*b*?
В реакціях гідролізу жирів хіміки-технологи враховують її оборотність. Щоб змістити рівновагу вправо, в бік утворення потрібних продуктів, наприклад, гліцерину, в промисловому синтезі застосовують луги. В цьому випадку гідроліз жирів відбувається практично до кінця: гідроксиди натрію або калію перетворюють многоосновние карбонові кислоти, які утворюються в солі і таким чином перешкоджають проходженню зворотної реакції утворення жиру. Подібним способом користуються при розкладанні водою складних ефірів в реакції омилення. Збільшуючи концентрацію гідроксид-іонів і розбавляючи реагуючу суміш, домагаються підвищення ступеня гідролізу ?, а значить, і виходу продуктів реакції спиртів і органічних кислот.
Цього рівноваги відповідає константа гідролізу: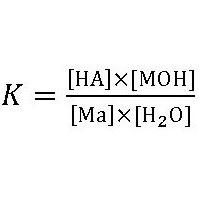 де: НА – кислота,
де: НА – кислота,
МОН – підстава,
МА – сіль.
Виходячи з того, що концентрація води в розбавлених розчинах є постійною, константа гідролізу буде мати вигляд:
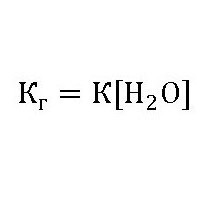 Спростивши першу формулу, отримаємо величину:
Спростивши першу формулу, отримаємо величину:
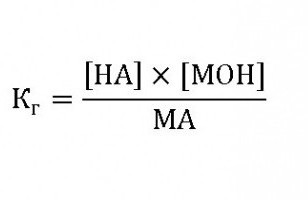 Це і є константа гідролізу солей – Кг. Її значення характеризує здатність речовини розкладатися водою, чим вона більше, тим швидше (при однакових температурі і концентрації солі) відбувається реакція. Так як константа гідролізу, формула якої Кг=[ОН]x[MA], то концентрація іонів гидроксогрупп буде:
Це і є константа гідролізу солей – Кг. Її значення характеризує здатність речовини розкладатися водою, чим вона більше, тим швидше (при однакових температурі і концентрації солі) відбувається реакція. Так як константа гідролізу, формула якої Кг=[ОН]x[MA], то концентрація іонів гидроксогрупп буде:
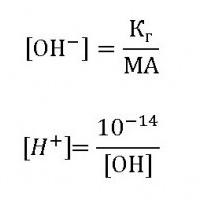 Для більшості солей гідроліз - процес оборотний. На величину ? впливає температура і концентрація розчину солі. Чим вище обидва ці параметра, тим більше ступінь і константа гідролізу. Це пояснюється тим, що при нагріванні різко зростає Сн+ і Сон-. Збільшення концентрації води, як видно з рівняння гідролізу, зміщує рівновагу вправо. Проте в реальних хімічних процесах доведено, що h солей, утворених слабкими кислотою і підставою, від розведення розчину не залежить.
Для більшості солей гідроліз - процес оборотний. На величину ? впливає температура і концентрація розчину солі. Чим вище обидва ці параметра, тим більше ступінь і константа гідролізу. Це пояснюється тим, що при нагріванні різко зростає Сн+ і Сон-. Збільшення концентрації води, як видно з рівняння гідролізу, зміщує рівновагу вправо. Проте в реальних хімічних процесах доведено, що h солей, утворених слабкими кислотою і підставою, від розведення розчину не залежить.
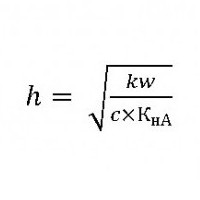 Реакція розчинів таких солей буде лужний. Її можна визначити з допомогою безбарвного індикатора фенолфталеїну, який при надлишку гідроксильних іонів стає малиновим. Фіолетовий лакмус у лужному розчині набуває синє забарвлення, а метилоранж – жовту. Карбонат натрію, як сильний електроліт, при розчиненні у воді повністю дисоціює на катіони металу та аніони кислотного залишку. Саме останні взаємодіють з іонами водню і гидроксогрупп. Катіони натрію не можуть зв'язати іони ВІН - в молекули гідроксиду натрію, так як він є сильним електролітом і в розчині ніколи не присутній як молекула. У той же час карбонат-іони зв'язуються з Н+ з утворенням слабкого електроліту – вугільної кислоти - до тих пір, поки в розчині не встановиться рівновага.
Реакція розчинів таких солей буде лужний. Її можна визначити з допомогою безбарвного індикатора фенолфталеїну, який при надлишку гідроксильних іонів стає малиновим. Фіолетовий лакмус у лужному розчині набуває синє забарвлення, а метилоранж – жовту. Карбонат натрію, як сильний електроліт, при розчиненні у воді повністю дисоціює на катіони металу та аніони кислотного залишку. Саме останні взаємодіють з іонами водню і гидроксогрупп. Катіони натрію не можуть зв'язати іони ВІН - в молекули гідроксиду натрію, так як він є сильним електролітом і в розчині ніколи не присутній як молекула. У той же час карбонат-іони зв'язуються з Н+ з утворенням слабкого електроліту – вугільної кислоти - до тих пір, поки в розчині не встановиться рівновага.
При гідролізі солей слабких основ AlCl3 FeSO4:
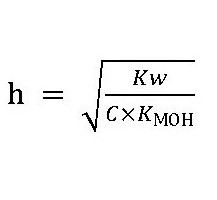 Реакція розчинів таких солей буде кисла, рН менше 7. У даному випадку утворюється слабкий електроліт Al(OH)3. Частина іонів водню, залишаючись вільними, обумовлює підкислення розчину: індикатор лакмус це знижує зміною фіолетового забарвлення на червоний. В результаті зміщується іонну рівновагу дисоціації води і утвориться надлишок водневих іонів. Якщо в обмінну реакцію з водою вступають солі слабкої основи і слабкої кислоти (NH4) CH3COO, NH4CN, то
Реакція розчинів таких солей буде кисла, рН менше 7. У даному випадку утворюється слабкий електроліт Al(OH)3. Частина іонів водню, залишаючись вільними, обумовлює підкислення розчину: індикатор лакмус це знижує зміною фіолетового забарвлення на червоний. В результаті зміщується іонну рівновагу дисоціації води і утвориться надлишок водневих іонів. Якщо в обмінну реакцію з водою вступають солі слабкої основи і слабкої кислоти (NH4) CH3COO, NH4CN, то
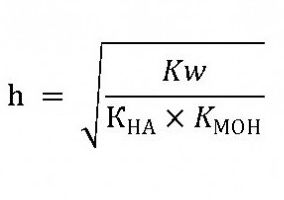 Розчини таких солей, що гідролізують особливо легко, і їх рН буде залежати від ступеня дисоціації і кислоти і основи. Якщо концентрація іонів Н+ буде більше, то рН буде менше 7. При надлишку гидроксидионов – рН більше 7 а в разі приблизно однакового їх кількості – розчин стане нейтральним. Таким чином гідроліз солей відбувається тоді, коли їх іони, які утворюються в результаті електролітичної дисоціації, способи утворювати з водою слабкі (малодиссоциированние електроліти)
Розчини таких солей, що гідролізують особливо легко, і їх рН буде залежати від ступеня дисоціації і кислоти і основи. Якщо концентрація іонів Н+ буде більше, то рН буде менше 7. При надлишку гидроксидионов – рН більше 7 а в разі приблизно однакового їх кількості – розчин стане нейтральним. Таким чином гідроліз солей відбувається тоді, коли їх іони, які утворюються в результаті електролітичної дисоціації, способи утворювати з водою слабкі (малодиссоциированние електроліти)
Додамо також наступне: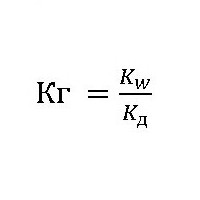 Константа гідролізу солей, визначається за цією формулою, показує, що закон Оствальда, має вигляд:
Константа гідролізу солей, визначається за цією формулою, показує, що закон Оствальда, має вигляд: 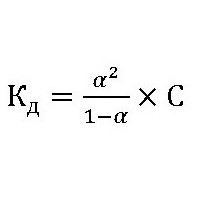 можна застосувати не тільки для електролітичної дисоціації, але і для процесу розкладання речовини водою. У разі якщо сіль утворена сильною основою і сильною кислотою, то у водних розчинах вона не гідролізує, так як не відбувається утворення слабкого електроліту. Тобто в розчині постійно присутні у вільному стані чотири типи іонів: це катіони металу і водню і аніони гідроксильних груп і кислотних залишків. Для розчинів таких солей можна написати скорочене іонне рівняння, а вся реакція зводиться до утворення молекул води.
можна застосувати не тільки для електролітичної дисоціації, але і для процесу розкладання речовини водою. У разі якщо сіль утворена сильною основою і сильною кислотою, то у водних розчинах вона не гідролізує, так як не відбувається утворення слабкого електроліту. Тобто в розчині постійно присутні у вільному стані чотири типи іонів: це катіони металу і водню і аніони гідроксильних груп і кислотних залишків. Для розчинів таких солей можна написати скорочене іонне рівняння, а вся реакція зводиться до утворення молекул води.
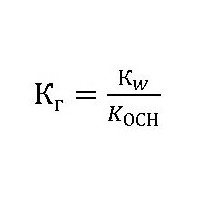 де: Kw – добуток води;
де: Kw – добуток води;
КОСН – константа дисоціації утворюється при гідролізі слабкого підстави NH4ОН.
Тоді константа гідролізу хлориду амонію буде дорівнює:
Це доводить, що при гідролізі розчин цієї солі має кислу реакцію.
Вода – універсальний розчинник
Гідроліз – це взаємодія речовин з водою, при якому складові частини хімічних сполук утворюють продукти реакції з іонами водню і гидроксогрупп молекул H 2 O. Враховуючи, що 79 % планети і до 80% маси всіх живих організмів становить вода, стає зрозуміло, що реакції гідролізу охоплюють всі прояви природних процесів, починаючи руйнуванням гірських порід і закінчуючи метаболізмом на всіх семи рівнях організації живої матерії, починаючи від молекулярного до біосферного.Математичний мову гідролізу
Чим складніше хімічний процес, тим більшої кількості формул і розрахунків він вимагає. Для обох видів обмінних реакцій речовин з водою як органічної, так і неорганічної хімії використовують математичні величини – це ступінь і константа гідролізу, позначаються як ? р і K р. Їх значення обчислюють і застосовують у технологічних процесах органічного синтезу, наприклад, при осахаривании крохмалю, гідролізі деревини, омилении жирів.Що таке ступінь гідролізу
Чим швидше речовина взаємодіє з водою, тим більше в такому розчині буде його гідролізувати молекул. Відношення їх числа до загальному кількістю частинок хімічної сполуки в розчині і називається ступенем гідролізу. У неорганічної хімії її прийнято позначати як h, в органічній ? р . Її виражають у частках від одиниці або у відсотках. Наприклад, якщо у воді буде розчинено 2 моль речовини, а прогидролизовало 001 моль, то h=001/2=0005 або 05 %.Константа гідролізу
Ця величина показує здатність речовини гидролизоваться. Чим вона вища, тим швидше молекули растворяемого речовини взаємодіють з іонами водню і гідроксильних груп води. Її позначають як До р , вираз для константи гідролізу може бути представлено формулою: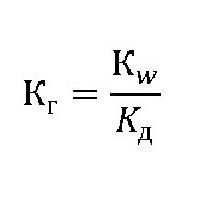
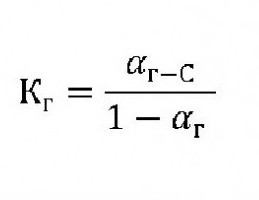
Особливості гідролізу органічних сполук
Обмінні реакції з водою у білків, вуглеводів і жирів протікають багатоступінчаста і досить складно. Тому і константа гідролізу, формула якої: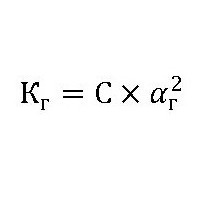
В реакціях гідролізу жирів хіміки-технологи враховують її оборотність. Щоб змістити рівновагу вправо, в бік утворення потрібних продуктів, наприклад, гліцерину, в промисловому синтезі застосовують луги. В цьому випадку гідроліз жирів відбувається практично до кінця: гідроксиди натрію або калію перетворюють многоосновние карбонові кислоти, які утворюються в солі і таким чином перешкоджають проходженню зворотної реакції утворення жиру. Подібним способом користуються при розкладанні водою складних ефірів в реакції омилення. Збільшуючи концентрацію гідроксид-іонів і розбавляючи реагуючу суміш, домагаються підвищення ступеня гідролізу ?, а значить, і виходу продуктів реакції спиртів і органічних кислот.
Розкладання водою неорганічних речовин
Практичне значення мають реакції гідролізу хімічних сполук, що належать до класу солей. Вони, як відомо, є продуктами обміну між кислотами і підставами. Так от, їх гідроліз буде залежати саме від того, якими саме гідроксидами і кислотами утворені солі. І ключовим тут буде поняття теорії електролітичної дисоціації про силу електролітів. Константа і ступінь гідролізу солей також будуть змінюватися, в залежності від складу іонів, що утворюють їх молекули.Чому pH солей різний
Досліди показують, що розчини різних солей можуть бути кислими (рН 7), хоча в їх молекулах немає ні водневих, ні гідроксильних іонів. Пояснення цим протиріччям потрібно шукати в процесі їх реакції з водою: Сіль+вода кислота + основу.Цього рівноваги відповідає константа гідролізу:
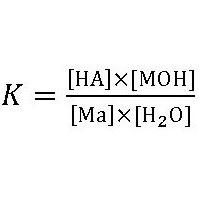
МОН – підстава,
МА – сіль.
Виходячи з того, що концентрація води в розбавлених розчинах є постійною, константа гідролізу буде мати вигляд:
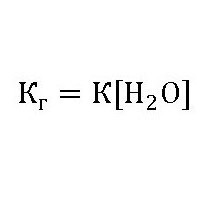
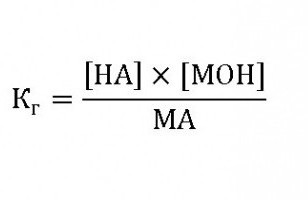
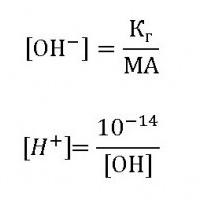
Ступінь гідролізу і ТЕД
У світлі теорії електролітичної дисоціації рівновагу процесу гідролізу залежить від уже відомої нам величини h або аг і ступеня гідролізу. Якщо водою розкладається сіль слабкої кислоти, наприклад Na2CO3 або К2Ѕ, то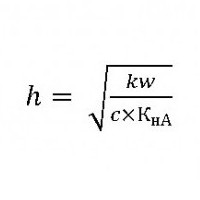
При гідролізі солей слабких основ AlCl3 FeSO4:
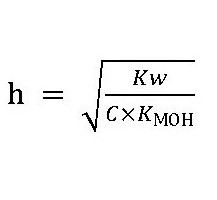
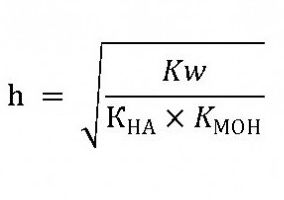
Додамо також наступне:
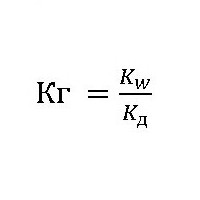
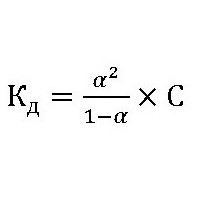
Обчислення константи гідролізу хлориду амонію
Щоб визначити цю величину слабкою основою і сильною кислотою, використовуємо співвідношення: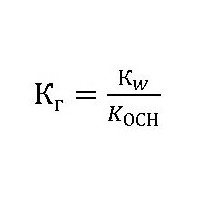
КОСН – константа дисоціації утворюється при гідролізі слабкого підстави NH4ОН.
Тоді константа гідролізу хлориду амонію буде дорівнює:
Це доводить, що при гідролізі розчин цієї солі має кислу реакцію.
Читайте також
НАУКА
Ступінь окислення азоту в амонії
НАУКА
Азотнокисле срібло. Формула, застосування

НАУКА
Діоксид вуглецю: формула, властивості та області застосування

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Алюміній сульфат та інші сполуки алюмінію в природі та житті людини

НАУКА
Солі амонію: властивості. Солі амонію: застосування
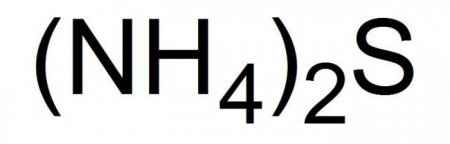
НАУКА
Сульфід амонію: отримання, гідроліз, застосування
НАУКА
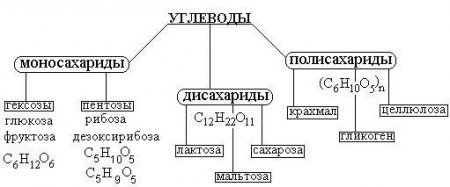
Будова та класифікація вуглеводів