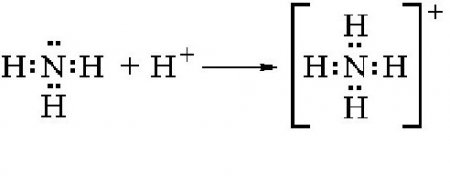Солі амонію: властивості. Солі амонію: застосування
Амоній – одне з численних сполук азоту. Його солі мають ряд цікавих властивостей і знаходять практичне застосування в багатьох областях людської діяльності. Дослідженням властивостей цього елемента займається хімія. Солі амонію вивчаються в розділі дослідження взаємодій азоту з іншими хімічними елементами.
 Тому NH 3 активно вступає в різні ковалентні зв'язки з іншими елементами, задіюючи нерозподілений електронну пару. Якщо з'єднання набирає ядро водню, то утворюється іон амонію. Схема реакції наведена нижче: Як можна бачити, в даній реакції молекула аміаку є акцептором одного протона і тим самим веде себе як підстава. Амоній у вільному вигляді не існує, оскільки практично миттєво розпадається на водень і аміак. Солі амонію виходять в результаті взаємодії цього елемента з іншими речовинами. Як показують практичні досліди, амоній вступає в різні сполуки з кислотами, нейтралізуючи їх і утворюючи солі амонію. Наприклад, у разі вступу в реакцію з соляною кислотою відбувається утворення однієї з солей цього елемента:
Тому NH 3 активно вступає в різні ковалентні зв'язки з іншими елементами, задіюючи нерозподілений електронну пару. Якщо з'єднання набирає ядро водню, то утворюється іон амонію. Схема реакції наведена нижче: Як можна бачити, в даній реакції молекула аміаку є акцептором одного протона і тим самим веде себе як підстава. Амоній у вільному вигляді не існує, оскільки практично миттєво розпадається на водень і аміак. Солі амонію виходять в результаті взаємодії цього елемента з іншими речовинами. Як показують практичні досліди, амоній вступає в різні сполуки з кислотами, нейтралізуючи їх і утворюючи солі амонію. Наприклад, у разі вступу в реакцію з соляною кислотою відбувається утворення однієї з солей цього елемента:
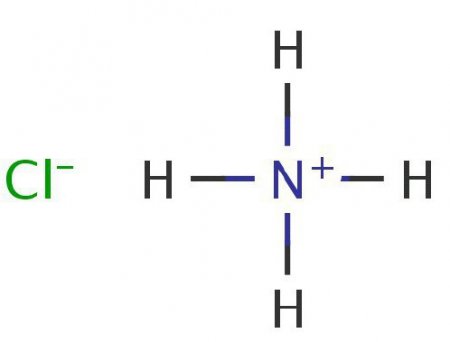
NH 3 + HCl = NH 4 Cl В результаті реакції виходить хлорид солі амонію.
- Солі NH 4 є хорошими електролітами. Вони піддаються гідролізу в різних розчинах. Цю реакцію можна простежити на прикладі дисоціації хлориду амонію: NH 4 Cl= NH 4 + + HCl - - Схильні до гідролізу. У результаті виходить реакція солі слабкої підстави і сильної кислоти: - мають іонну кристалічну решітку, володіють електропровідністю; - не витримують високих температур і розпадаються на складові. Грунти у природному середовищі містять незначну кількість азоту. Після збору кожного врожаю разом з рослинами несеться і то мала кількість азоту, яке раніше перебувало в землі. Щоб прискорити процес регенерації ґрунту, і застосовуються азотні добрива. Сульфат амонію. Формула цього з'єднання - (NH4) 2 SO 4. Ця сіль амонію служить основою для безлічі добрив. Нітрат амонію. Формула цієї речовини - NH 4 NO 3 . Це також відоме добриво, яке добре засвоюється рослинами. Крім сільськогосподарського застосування, нітрат амонію використовується у військовій і гірничодобувній галузі – на його основі виготовляються вибухові суміші (амонали), які застосовують для підривних робіт.
Грунти у природному середовищі містять незначну кількість азоту. Після збору кожного врожаю разом з рослинами несеться і то мала кількість азоту, яке раніше перебувало в землі. Щоб прискорити процес регенерації ґрунту, і застосовуються азотні добрива. Сульфат амонію. Формула цього з'єднання - (NH4) 2 SO 4. Ця сіль амонію служить основою для безлічі добрив. Нітрат амонію. Формула цієї речовини - NH 4 NO 3 . Це також відоме добриво, яке добре засвоюється рослинами. Крім сільськогосподарського застосування, нітрат амонію використовується у військовій і гірничодобувній галузі – на його основі виготовляються вибухові суміші (амонали), які застосовують для підривних робіт.
Що таке амоній
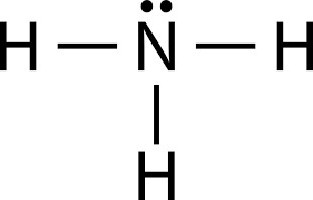
Щоб дізнатися, що таке амоній, слід більш уважно ознайомитися з принципом сполуки азоту й атомів вуглецю. Молекула аміаку записується у вигляді NH 3. Атом азоту пов'язаний своїми ковалентними зв'язками з трьома протонами. Внаслідок внутрішньої структури азоту одна зв'язок залишається нерозподіленим.
NH 3 + HCl = NH 4 Cl В результаті реакції виходить хлорид солі амонію.
Взаємодія з водою
Амоній добре взаємодіє з водою. У результаті реакції утворюються гідрати аміаку посиленою концентрацією ВІН - . Хімічна запис реакції: NH 3 + H 2 O -> NH 4 + OH - Оскільки кількість іонів гидроксогруппи надзвичайно велике, то водні розчини аміаку мають лужної реакцією. Однак за старої хімічної звичкою водний розчин аміаку записують, як NH 4 OH. Дана речовина називається гідроксидом амонію, а лужну реакцію цього з'єднання розглядають у вигляді дисоціації молекул, на які розкладається аміак.Солі амонію. Властивості і основні характеристики
Велика частина солей NH 4 практично безбарвні і досить добре розчиняються у воді. Дане з'єднання володіє багатьма властивостями металів, тому і солі амонію ведуть себе так само, як і солі різних металів. Ось кілька прикладів такого подібності:- Солі NH 4 є хорошими електролітами. Вони піддаються гідролізу в різних розчинах. Цю реакцію можна простежити на прикладі дисоціації хлориду амонію: NH 4 Cl= NH 4 + + HCl - - Схильні до гідролізу. У результаті виходить реакція солі слабкої підстави і сильної кислоти: - мають іонну кристалічну решітку, володіють електропровідністю; - не витримують високих температур і розпадаються на складові.
Необоротні і оборотні процеси
Розпад солей амонію під впливом температур може бути незворотній, або ж являти собою оборотний процес. Якщо аніон солі проявляє несильні властивості окислювача, солі розпадається оборотно. Класичним прикладом такої реакції є хлорид амонію: при підвищенні температури реакції він врешті-решт розпадається на власні вихідні елементи - хлористий водень, а також аміак. Якщо стінки судини не прогрівати, на них з'являється наліт. Так генерується хлорид амонію. Інші солі цього елемента, аніон в яких має яскраво виражені властивості окислювача, розпадаються безповоротно. Стандартним прикладом такої реакції може служити розпад нітрату амонію, який виглядає наступним чином: NH 4 NO 3 = N 2 O ?+ H 2 O Оскільки один з продуктів взаємодії залишає поле, реакція припиняється.Застосування аміаку і солей амонію
Вагома частка аміаку, що видобувається промисловим шляхом, йде на застосування його в установках для заморожування та охолодження. Знаходять солі амонію застосування в повсякденному житті і в медицині. Але переважна частина аміаку йде на виготовлення азотної кислоти і різноманітних азотовмісних сполук, перш за все, різних мінеральних добрив.Азотисті добрива
Найбільш відомі солі похідної азоту, застосування яких в господарській діяльності вкрай важливо – це сульфат амонію, нітрат амонію, хлорид амонію. Азот – необхідна складова частина білків. Цей елемент є обов'язковим для існування будь-якого живого організму. Рослини беруть азот із родючого ґрунту, де цей елемент знаходиться переважно у зв'язаному вигляді. Зазвичай азот зустрічається, як солі амонію і з'єднання азотної кислоти. Розчиняючись у вологому грунті, ці неорганічні сполуки потрапляють в організми рослин і переробляються ними в різні білки і амінокислоти. Тварини і люди не можуть засвоювати азот ні у вільному вигляді, ні в якості простих сполук. Для живлення і росту їм необхідний білок, складовою частиною якого обов'язково є азот. Тільки за участю рослин ми отримуємо настільки необхідний елемент для життя і здоров'я.
Нашатир
Хлорид амонію. Добре відомий, як нашатир. Його хімічна формула - NH 4 Cl. Це з'єднання добре відомо у виробництві лакофарбової продукції, в текстильному справі, використовується нашатир і в гальванічних елементах. Добре відомий хлорид амонію пайовикам і лудильщикам. У своїй роботі вони часто задіяні хлористі солі амонію. Застосування цієї речовини допомагає видалити з поверхні металів найтонші оксидні плівки. Дотик розігрітого металу до нашатирю викликає відповідну реакцію оксидів – вони або переходять на хлориди, або відновлюються. Хлориди швидко випаровуються з поверхні металу. Процес реакції для міді може бути записаний наступним чином: 4CuO + 2 NH 4 Cl = 3Cu + 2CuCl 2 + N 2 +4H 2 O. Аміак в рідкому вигляді і міцні розчини солей амонію також застосовуються в якості азотних добрив – вміст азоту в них вище, ніж у твердих добривах, і він краще засвоюється рослинами.Читайте також

НАУКА
Що таке каучук, його види

НАУКА
Солі вуглеамонійні: опис, склад, сфера застосування

НАУКА
Що таке азот? Маса азоту. Молекула азоту
НАУКА
Оксид азоту: формула, властивості, застосування
НАУКА
Ступінь окислення азоту в амонії

НАУКА
Ступінь і константа гідролізу

НАУКА
Оксид калію: формула, взаємодія
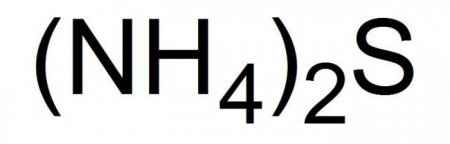
НАУКА
Сульфід амонію: отримання, гідроліз, застосування