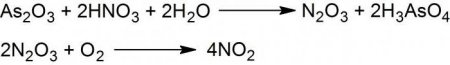Оксид азоту: формула, властивості, застосування
Оксидами називають бінарні сполуки хімічних елементів з кисневим атомом, у якого окислювальна ступінь дорівнює 2-. Азот, що володіє меншим електронегативний значенням, утворює різні комбінації з киснем. Ці сполуки відносяться до різних класів речовин. Оксид азоту містить кисень у кількості, яка встановлює валентність елемента N. Вона коливається від 1 до 5.
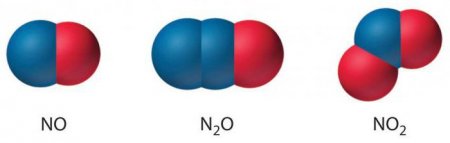
Інші з'єднання вважаються менш поширеними. До них відносять оксид азоту четирехвалентного у формі димера, нестабільні молекули нитрилазида, нитрозилазида, тринитрамида і нітратний радикал. Одновалентного азоту оксид має формулу N 2 O. В ньому атом N заряджений +1. Азоту двовалентного оксид має формулу NO. У ньому атом N заряджений +2. Азоту тривалентного оксид має формулу N 2 O 3 . У ньому атом N заряджений +3. Чотирьохвалентний оксид азоту, формула якого NO 2 , має заряд атома N +4. Пятивалентное кисневе з'єднання позначається як N 2 O 5 . У ньому атом N заряджений +5. 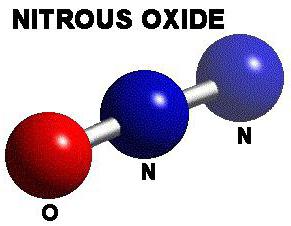
Оксид азоту з валентністю I в умовах нормальної температури існує у формі негорючого газу, без кольору, який проявляє приємний солодкуватий присмак і запах. Повітря легше даного з'єднання. Оксид розчиняється у водному середовищі, етанолі, ефірах та сірчаної кислоті. Вода, лужні і кислотні розчини не здатні з ним вступати в реакцію, він не утворює солі. Не піддається займання, зате здатний підтримати процес горіння. Аміак оксид азоту переводить в азид (N3NH4). При з'єднанні з молекулами ефірів, хлоретана і циклопропана утворюється вибухонебезпечна суміш. Звичайні умови сприяють його інертності. Під дією нагрівання речовина відновлюється. Оксид азоту може бути відновником в реакціях взаємодії з галогенами. Продуктом їх приєднання є нитрозилгалогенид, який має формулу NOBr. Діоксид сірки та інші сильні відновники окислюють NO з отриманням молекул N 2 .
Оксид азоту може бути відновником в реакціях взаємодії з галогенами. Продуктом їх приєднання є нитрозилгалогенид, який має формулу NOBr. Діоксид сірки та інші сильні відновники окислюють NO з отриманням молекул N 2 .
Молекули N 2 O 3 дисоціюють під час нагрівання з виділенням одно - та оксиду двовалентного. Як ангідриду приєднує воду з отриманням азотистої кислоти, а з лугом формує солі у вигляді нітритів.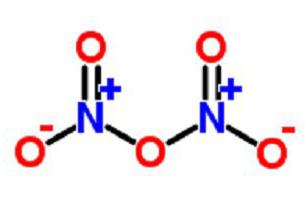 Існує у формі безбарвних кристалів, які володіють летючістю і нестійкістю. Їх стабільність спостерігається при низькій температурі. Таку структуру утворюють нітрат - і нітрит-іони. В газоподібному вигляді речовина має форму ангідриду NO 2 –O–NO 2 . Оксид азоту п'ятивалентний володіє кислотними властивостями. Він легко розкладається з виділенням кисню. Речовина реагує з водою, в результаті виходить азотна кислота. Луги розчиняють ангідрид з виділенням солей нітратів.
Існує у формі безбарвних кристалів, які володіють летючістю і нестійкістю. Їх стабільність спостерігається при низькій температурі. Таку структуру утворюють нітрат - і нітрит-іони. В газоподібному вигляді речовина має форму ангідриду NO 2 –O–NO 2 . Оксид азоту п'ятивалентний володіє кислотними властивостями. Він легко розкладається з виділенням кисню. Речовина реагує з водою, в результаті виходить азотна кислота. Луги розчиняють ангідрид з виділенням солей нітратів.
У промислових масштабах його добувають за рахунок окислення аміачних молекул під час нагрівання і під високим тиском. Прискорювачем процесу є платина або тривалентного хрому оксид. Діоксид, або NO 2 виходить при взаємодії арсену оксиду тривалентного з 50 % азотної кислотою, яку наносять по краплях на поверхню твердого реагенту. Утворюється суміш оксидів двовалентного і четирехвалентного азоту. Якщо її охолодити до температури -30 °С, то синтезується азотистий ангідрид, або N 2 O 3 . В порошкоподібному вигляді він виходить в разі пропускання електричного струму крізь газоподібну форму. Якщо на крохмальний порошок подіяти азотною кислотою з концентрацією 50 %, то виділяється оксид двовалентного і четирехвалентного азоту, вуглекислий газ і вода. Надалі з отриманих перших двох сполук формується молекула N 2 O 3 . У результаті теплового розщеплення свинцевого нітросполуки виділяється діоксид азоту, вільний кисень та оксид свинцю. Ангідрид, або N 2 O 5 утворюється завдяки відщеплювання молекули води від азотної кислоти дією оксиду фосфору пятивалентного. Інший спосіб його синтезу є пропускання сухого хлору крізь безводний срібний нітрат. Якщо на діоксид азотний подіяти молекулами озону, то формується N 2 O 5 .
Які бувають оксиди
Існує близько десятка азотистих сполук, що містять O-елемент. З них п'ять найбільш поширених: оксид одновалентного, оксид двовалентного, оксид тривалентного, оксид четирехвалентного і оксид пятивалентного азоту.Інші з'єднання вважаються менш поширеними. До них відносять оксид азоту четирехвалентного у формі димера, нестабільні молекули нитрилазида, нитрозилазида, тринитрамида і нітратний радикал.
Формули оксидів азоту
Нижче наведено позначення найбільш значущих сполук елемента N. Це насамперед оксид азоту, формула якого складається з двох хімічних знаків - N і O. За ними ставляться індекси, в залежності від ступеня окислення атомів.Опис оксиду одновалентного азоту
Він ще іменується диазотом, закисом і звеселяючим газом. Остання назва сталося від дії, пов'язаного з сп'янінням.
Оксид азоту з валентністю I в умовах нормальної температури існує у формі негорючого газу, без кольору, який проявляє приємний солодкуватий присмак і запах. Повітря легше даного з'єднання. Оксид розчиняється у водному середовищі, етанолі, ефірах та сірчаної кислоті. Вода, лужні і кислотні розчини не здатні з ним вступати в реакцію, він не утворює солі. Не піддається займання, зате здатний підтримати процес горіння. Аміак оксид азоту переводить в азид (N3NH4). При з'єднанні з молекулами ефірів, хлоретана і циклопропана утворюється вибухонебезпечна суміш. Звичайні умови сприяють його інертності. Під дією нагрівання речовина відновлюється.
Опис оксиду двовалентного азоту
Його ще називають моноокисью, окисом або нитрозил-радикалом. В умовах нормальної температури є безбарвним негорючим газом, слаборастворимим у водному середовищі. Повітрям окислюється, виходить NO 2. Рідка і тверда його форма стають блакитного кольору.
Опис оксиду тривалентного азоту
Вони іменується ангідридом баланс азоту. В нормальному стані може бути рідиною, з синім забарвленням, а стандартні параметри середовища переводять оксид у форму газу, не має кольору. Володіє стійкістю тільки при низьких температурах.Молекули N 2 O 3 дисоціюють під час нагрівання з виділенням одно - та оксиду двовалентного. Як ангідриду приєднує воду з отриманням азотистої кислоти, а з лугом формує солі у вигляді нітритів.
Опис оксиду четирехвалентного азоту
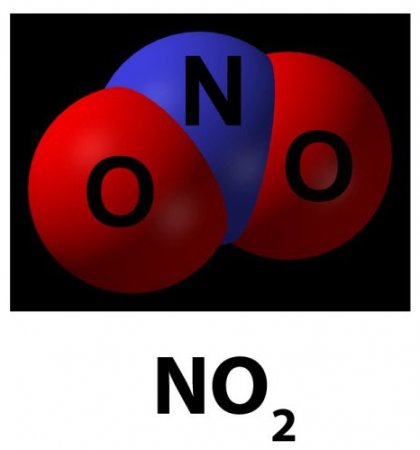
По-іншому його називають діоксидом. Існує у формі буро-червоного газу, у якого є гострий запах, а також може бути жовтуватою рідиною. Відноситься до кислотних оксидам, у яких розвинена добре хімічна активність. Його молекули окислюють неметали з утворенням кисневмісних сполук і вільного азоту. Діоксид взаємодіє з оксидом чотирьохвалентної і шестивалентної сірки. Виходить кислота сірчана. Метод її синтезу називають нітрозним. У водному середовищі можна розчинити оксид азоту. Азотна кислота є результатом даної реакції. Такий процес називають диспропорционированием. Проміжним компонентом вважається азотиста кислота, котра швидко розпадається. Якщо розчинити азоту четирехвалентного оксид в лугу, то відбувається утворення розчинів нітратів і нітритів. Можна використовувати рідку форму для взаємодії з металом, тоді вийде безводна сіль.Опис оксиду пятивалентного азоту
Його також називають диазотним пентаоксидом, нітратом нитрония, нітрилові нітратом або азотним ангідридом.
Як отримують оксиди азоту
Закис N 2 O утворюється обережним при нагріванні амонію нітрату в сухому вигляді, проте такий спосіб може супроводжуватися вибухом. Кращим методом одержання оксиду одновалентного є вплив азотної кислотою в концентрованому вигляді на кислоту сульфаминовой. Головною умовою вважається нагрівання. Нитрозил, або NO, – це особливий оксид азоту, отримання якого здійснюється при взаємодії молекул N 2 і O 2 . Важливою умовою такого процесу є сильне нагрівання понад 1000 °C. Природний спосіб отримання пов'язаний з грозовими розрядами в атмосферному повітрі. Такий оксид швидко з'єднується з кисневими атомами та формується діоксид. Лабораторний метод синтезу NO пов'язаний з реакцією металів і неконцентрированной азотної кислоти. Прикладом такої реакції може бути взаємодія міді з HNO 3 . Інший спосіб утворення моноокиси азоту - реакція хлориду заліза двовалентного з натрію нітритом і соляною кислотою. Результатом процесу є тривалентного заліза й натрію, хлориди, вода і сама окис.У промислових масштабах його добувають за рахунок окислення аміачних молекул під час нагрівання і під високим тиском. Прискорювачем процесу є платина або тривалентного хрому оксид. Діоксид, або NO 2 виходить при взаємодії арсену оксиду тривалентного з 50 % азотної кислотою, яку наносять по краплях на поверхню твердого реагенту. Утворюється суміш оксидів двовалентного і четирехвалентного азоту. Якщо її охолодити до температури -30 °С, то синтезується азотистий ангідрид, або N 2 O 3 . В порошкоподібному вигляді він виходить в разі пропускання електричного струму крізь газоподібну форму. Якщо на крохмальний порошок подіяти азотною кислотою з концентрацією 50 %, то виділяється оксид двовалентного і четирехвалентного азоту, вуглекислий газ і вода. Надалі з отриманих перших двох сполук формується молекула N 2 O 3 . У результаті теплового розщеплення свинцевого нітросполуки виділяється діоксид азоту, вільний кисень та оксид свинцю. Ангідрид, або N 2 O 5 утворюється завдяки відщеплювання молекули води від азотної кислоти дією оксиду фосфору пятивалентного. Інший спосіб його синтезу є пропускання сухого хлору крізь безводний срібний нітрат. Якщо на діоксид азотний подіяти молекулами озону, то формується N 2 O 5 .
Читайте також

НАУКА
Що таке азот? Маса азоту. Молекула азоту
НАУКА
Ступінь окислення азоту в амонії
НАУКА
Гомогенні реакції: опис і приклади

НАУКА
Діоксид вуглецю: формула, властивості та області застосування

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Солі амонію: властивості. Солі амонію: застосування

НАУКА
Кисень: хімічні властивості елемента

НАУКА
Оксид барію: отримання і застосування