Діоксид вуглецю: формула, властивості та області застосування
Діоксид вуглецю (вуглекислий газ) - часто зустрічається в природі з'єднання. Воно утворюється при окисленні різних органічних речовин. Найбільш часто зустрічаються процеси утворення цієї сполуки - гниття тварин та рослинних решток, горіння різних видів палива, дихання тварин і рослин. Наприклад, одна людина за добу виділяє в атмосферу близько кілограма вуглекислого газу. Оксид і діоксид вуглецю можуть утворюватися і в неживій природі. Вуглекислий газ виділяється при вулканічній діяльності, а також може бути видобуто з мінеральних водних джерел. Вуглекислий газ знаходиться у невеликим кількості і в атмосфері Землі. 
Особливості хімічної будови даного з'єднання дозволяють йому брати участь у безліч хімічних реакцій, основою для яких є діоксид вуглецю.
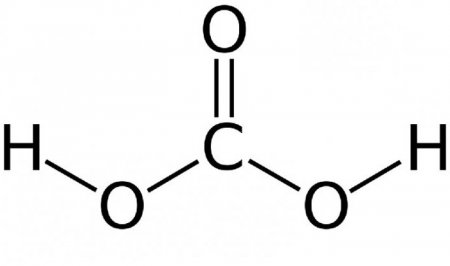
Запис хімічної реакції: CO 2 + H 2 O H 2 CO 3. Рівновага досить сильно зрушено вліво – лише близько 1% початкової вуглекислого газу перетворюється у вугільну кислоту. Чим вище температура, тим менше в розчині молекул вугільної кислоти. При кипінні з'єднання вона зникає повністю, і розчин розпадається на діоксид вуглецю і воду. Структурна формула вугільної кислоти представлена нижче.
CaCO 3 = CaO + CO 2 ?. У кулінарії часто використовують метод погашення лимонної кислоти оцтом. Виділяється при цьому вуглекислий газ надає пишність і легкість кондитерським виробам. Дане з'єднання часто використовується в якості харчової добавки, що підвищує термін зберігання харчових продуктах. Згідно міжнародним нормам класифікації хімічних добавок вмісту в продуктах, проходить під кодом Е 290 Порошкоподібний вуглекислий газ – одна з найбільш популярних речовин, що входять до складу пожаротушительних сумішей. Ця речовина зустрічається і в піні вогнегасників. Транспортувати та зберігати вуглекислий газ у металевих балонах. При температурі понад 31?С тиск в балоні може досягти критичного і рідкий ЗІ 2 перейде в надкритичний стан з різким підйомом робочого тиску до 735 МПа. Металевий балон витримує внутрішній тиск до 22 МПа, тому діапазон тиску при температурах понад тридцяти градусів визнається безпечним.
У кулінарії часто використовують метод погашення лимонної кислоти оцтом. Виділяється при цьому вуглекислий газ надає пишність і легкість кондитерським виробам. Дане з'єднання часто використовується в якості харчової добавки, що підвищує термін зберігання харчових продуктах. Згідно міжнародним нормам класифікації хімічних добавок вмісту в продуктах, проходить під кодом Е 290 Порошкоподібний вуглекислий газ – одна з найбільш популярних речовин, що входять до складу пожаротушительних сумішей. Ця речовина зустрічається і в піні вогнегасників. Транспортувати та зберігати вуглекислий газ у металевих балонах. При температурі понад 31?С тиск в балоні може досягти критичного і рідкий ЗІ 2 перейде в надкритичний стан з різким підйомом робочого тиску до 735 МПа. Металевий балон витримує внутрішній тиск до 22 МПа, тому діапазон тиску при температурах понад тридцяти градусів визнається безпечним.

Особливості хімічної будови даного з'єднання дозволяють йому брати участь у безліч хімічних реакцій, основою для яких є діоксид вуглецю.
Формула
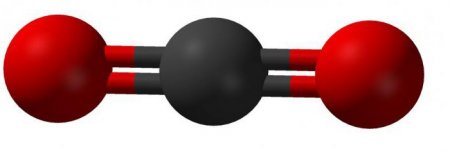
У з'єднанні цієї речовини чотирьохвалентний атом вуглецю утворює лінійну зв'язок з двома молекулами кисню. Зовнішній вигляд такої молекули можна представити так: Теорія гібридизації пояснює будову молекули діоксиду вуглецю так: дві існуючі сигма-зв'язку утворені між sp-орбіталей атомів вуглецю і двома 2р-орбіталей кисню; р-орбіталі вуглецю, які не беруть участь в гібридизації, пов'язані в з'єднанні з аналогічними орбіталей кисню. У хімічних реакціях вуглекислий газ записується у вигляді: CO 2.Фізичні властивості
При нормальних умовах діоксид вуглецю являє собою безбарвний газ, який не володіє запахом. Він важчий за повітря, тому вуглекислий газ і може вести себе, як рідина. Наприклад, його можна переливати з однієї ємності в іншу. Це речовина трохи розчиняється в воді – в одному літрі води при 20 ?З розчиняється близько 088 л CO 2 . Невелике зниження температури кардинально змінює ситуацію – в тому ж літрі води за 17?Може розчинитися 17 л CO 2 . При сильному охолодженні це речовина осідає у вигляді сніжинок – утворюється так званий «сухий лід». Така назва походить від того, що при нормальному тиску речовина, минаючи рідку фазу, відразу перетворюється в газ. Рідкий діоксид вуглецю утворюється при тиску трохи вище 06 МПа і при кімнатній температурі.
Хімічні властивості
При взаємодії з сильними окислювачами 4-діоксид вуглецю виявляє окисні властивості. Типова реакція цієї взаємодії: З + З 2 = 2СО. Так, за допомогою вугілля діоксид вуглецю відновлюється до своєї двовалентній модифікації - чадного газу. При нормальних умовах вуглекислий газ інертний. Але деякі активні метали можуть в ньому горіти, витягуючи з з'єднання кисень і вивільняючи газоподібний вуглець. Типова реакція – горіння магнію: 2Mg + CO 2 = 2MgO + C. В процесі реакції утворюється оксид магнію і вільний вуглець. У хімічних сполуках ЗІ 2 часто проявляє властивості типового кислотного оксиду. Наприклад, він реагує з підставами та основними оксидами. Результатом реакції стають солі вугільної кислоти. Наприклад, реакція сполуки оксиду натрію з вуглекислим газом може бути представлена так: Na 2 O + CO 2 = Na 2 CO 3 ; 2NaOH + CO 2 = Na 2 CO 3 + H 2 O; NaOH + CO 2 = NaHCO 3 .Вугільна кислота та розчин З 2
Діоксид вуглецю у воді утворює розчин з невеликим ступенем дисоціації. Такий розчин вуглекислого газу називається вугільної кислотою. Вона безбарвна, слабо виражена і має кислуватий смак.Запис хімічної реакції: CO 2 + H 2 O H 2 CO 3. Рівновага досить сильно зрушено вліво – лише близько 1% початкової вуглекислого газу перетворюється у вугільну кислоту. Чим вище температура, тим менше в розчині молекул вугільної кислоти. При кипінні з'єднання вона зникає повністю, і розчин розпадається на діоксид вуглецю і воду. Структурна формула вугільної кислоти представлена нижче.
Властивості вугільної кислоти
Вугільна кислота дуже слабка. У розчинах вона розпадається на іони водню Н + і з'єднання НСТ 3 - . У дуже невеликій кількості утворюються іони З 3 - . Вугільна кислота – двухосновная, тому солі, утворені нею, можуть бути середніми і кислими. Середні солі в російській хімічної традиції називаються карбонатами, а сильні – гидрокарбонатами.Якісна реакція
Одним з можливих способів виявлення газоподібного діоксиду вуглецю є зміна прозорості вапняного розчину. Ca(OH) 2 + CO 2 = CaCO 3 ? + H 2 O. Цей досвід відомий ще з шкільного курсу хімії. На початку реакції утворюється невелика кількість білого осаду, який згодом зникає при пропущенні через воду вуглекислого газу. Зміна прозорості відбувається тому, що в процесі взаємодії нерозчинну сполуку – карбонат кальцію перетворюється на розчинну речовину – гідрокарбонат кальцію. Реакція протікає по такому шляху: CaCO 3 + H 2 O + CO 2 = Ca(HCO 3 ) 2 .Отримання діоксиду вуглецю
Якщо потрібно отримати невелику кількість СО2 можна запустити реакцію соляної кислоти з карбонатом кальцію (мармуром). Хімічна запис цієї взаємодії виглядає так: CaCO 3 + HCl = CaCl 2 + H 2 O + CO 2 ?. Також для цієї мети використовують реакції горіння вуглецевмісних речовин, наприклад ацетилену: СН 4 + 2О 2 -> 2H 2 O + CO 2 . Для збору і зберігання отриманого газоподібного речовини використовують апарат Киппа. Для потреб промисловості і сільського господарства масштаби отримання діоксиду вуглецю повинні бути великими. Популярним методом такої масштабної реакції є випал вапняку, в результаті якого виходить діоксид вуглецю. Формула реакції наведена нижче:CaCO 3 = CaO + CO 2 ?.
Застосування діоксиду вуглецю
Харчова промисловість після масштабного одержання «сухого льоду» перейшла на принципово новий метод зберігання продуктів. Він незамінний при виробництві газованих напоїв і мінеральної води. Утримання З 2 у напоях надає їм свіжість і помітно збільшує термін зберігання. А карбідізация мінеральних вод дозволяє уникнути затхлості і неприємного смаку.
Читайте також

НАУКА
Основні види газів
НАУКА
Оксид азоту: формула, властивості, застосування
НАУКА
Концентрована сірчана кислота: властивості, реакції
НАУКА
Як обчислити площу трикутника

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Солі амонію: властивості. Солі амонію: застосування
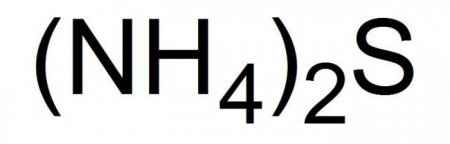
НАУКА
Сульфід амонію: отримання, гідроліз, застосування

НАУКА
Кисень: хімічні властивості елемента