Оксид калію: формула, взаємодія
У неорганічної хімії існує три основних класу сполук. Це кислоти, луги і оксиди. Кислота складається з катіонів водню і аніону кислотного залишку. Луг - з катіона металу і гідроксильної групи. Про оксидах ми поговоримо докладніше далі.
У цій статті ми більш докладно поговоримо про оксид калію. А саме - про його фізичних і хімічних властивостях, про його застосування в різних галузях промисловості. До 2 О + Н 2 Про = 2КОН Знаючи молярную масу кожної з речовин, з рівняння можна зробити наступний висновок: з 94 грамів розглянутого оксиду і 18 грамів води можна отримати 112 грамів калій гідроксиду.
До 2 О + З 2 = До 2 З 3 Так, можна зробити висновок, що з 94 грамів розглянутого оксиду і 44 грамів вуглекислого газу виходить 138 грамів калій карбонату. Також розглянутий оксид може вступати в реакцію з оксидом сульфур. При цьому утворюється інша сіль - калій сульфат. Взаємодія оксиду калію з оксидом сульфур можна виразити таким рівнянням: До 2 Про + SO 3 = K 2 SO 4 З нього видно, що, взявши 94 грами розглянутого оксиду і 80 грамів оксиду сульфуру, можна отримати 174 г сульфату калію. Таким же чином До 2 Про може реагувати і з іншими оксидами. Інший тип взаємодії - реакції не з кислотними, а з амфотерними оксидами. У такому разі утворюється кислота, а сіль. Прикладом такого хімічного процесу може служити взаємодія розглянутого оксиду з оксидом цинку.
Цю реакцію можна виразити таким рівнянням: До 2 Про + ZnO = K 2 ZnO 2 З нього видно, що при взаємодії розглянутого оксиду та оксиду цинку утворюється сіль під назвою калій цинкат. Якщо знати молярную масу всіх речовин, то можна підрахувати, що з 94 грамів До 2 Про 81 грама оксиду цинку можна отримати 175 грамів калій цинката. Також До 2 Про здатний взаємодіяти з оксидом азоту. При цьому утворюється суміш двох солей: нітрату і нітриту калію. Рівняння цієї реакції виглядає таким чином: До 2 Про + 2NO 2 = KNO 3 + KNO 2 Якщо знати молярні маси речовин, можна сказати, що з 94 грамів розглянутого оксиду і 92 грамів оксиду нітрогену можна отримати 101 грам нітрату і 85 грамів нітриту. 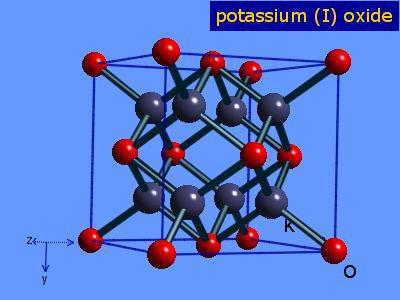
До 2 Про + H 2 SO 4 = K 2 SO 4 + Н 2 Про З рівняння можна зробити висновок, що для отримання 174 грамів сульфату калію і 18 грамів води необхідно взяти 94 грами розглянутого оксиду і 98 грамів сірчаної кислоти. Схожим чином відбувається хімічна взаємодія між розглянутим оксидом і азотною кислотою. При цьому утворюється нітрат калію і вода. Рівняння цієї реакції можна записати наступним чином: 2К 2 Про + 4HNO 3 = 4KNO 3 + 2Н 2 Про Таким чином, з 188 грамів розглянутого оксиду і 252 грамів азотної кислоти можна отримати 404 г нітрату калію і 36 грамів води. За таким же принципом розглянутий оксид може реагувати і з іншими кислотами. В процесі цього будуть утворюватися інші солі і вода. Так, наприклад, при реакції цього оксиду з фосфорною кислотою виходить фосфат і вода, з хлоридною кислотою - хлорид вода та так далі.
До 2 Про + СІ 2 = КСІ + КСІО В результаті такої взаємодії утворюється дві солі: хлорид і гіпохлорит калію. З 94 грам розглянутого оксиду і 70 грамів хлору виходить 74 грама хлориду калію і 90 грам гіпохлориту калію. До 2 Про + NH 3 = КОН + KNH 2 Знаючи молярні маси всіх речовин, можна обчислити пропорції реагентів і продуктів реакції. З 94 грамів розглянутого оксиду і 17 грамів аміаку можна отримати 56 грамів гідроксиду калію і 55 грамів аміду калію. З нітрату калію і металевого калію. Ці два реагенту нагрівають, в результаті чого утворюється До 2 Про і азот. Рівняння реакції виглядає наступним чином: 2KNO 3 + 10К = N 2 + 6К 2 О. Другий спосіб відбувається у два етапи. Спочатку відбувається реакція між калієм і киснем, в результаті чого утворюється пероксид калію. Рівняння реакції виглядає так: 2К + ПРО 2 = До 2 Про 2 . Далі пероксид збагачують калієм, в результаті чого отримують оксид калію. Рівняння реакції можна записати таким чином: До 2 Про 2 + 2К = 2К 2 О.
Що таке оксид?
Це з'єднання, що складається з двох різних хімічних елементів, одним з яких є кисень. Другим же може бути метал або металоїд. Кількість атомів кисню залежить від валентності другого хімічного елемента, що входить до складу з'єднання. Так, наприклад, валентність калію дорівнює одному, тому оксид калію буде містити один атом кисню і два атоми калію. Валентність кальцію дорівнює двом, тому його оксид буде складатися з одного атома кисню і одного атома кальцію. Валентність фосфору дорівнює п'яти, тому його оксид складається з двох атомів фосфору і п'яти атомів кисню.У цій статті ми більш докладно поговоримо про оксид калію. А саме - про його фізичних і хімічних властивостях, про його застосування в різних галузях промисловості.
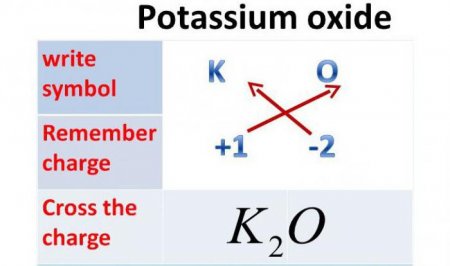
Оксид калію: формула
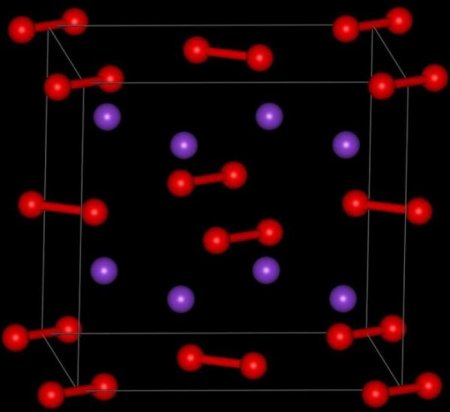
Так як валентність даного металу дорівнює одному, а валентність кисню - двом, то це хімічна сполука буде складатися з двох атомів металу і одного атома Оксигена. Отже, оксид калію: формула - До 2 О.Фізичні властивості
Розглянутий оксид має блідо-жовтим забарвленням. Іноді він може бути і безбарвним. При кімнатній температурі він володіє твердим агрегатним станом. Температура плавлення цієї речовини дорівнює 740 градусів Цельсія. Щільність складає 232 г/см 3 . При термічному розкладанні даного оксиду утворюється пероксид цього ж металу і чистий калій. Розчинний в органічних розчинниках. У воді не розчиняється, а вступає в реакцію з нею. Володіє високою гігроскопічністю.Хімічні властивості До 2 Про
Дана речовина має типовими для всіх основних оксидів хімічними властивостями. Розглянемо хімічні реакції даного оксиду з різними речовинами по порядку.Реакція з водою
В першу чергу воно здатне реагувати з водою з утворенням в результаті гідроксиду даного металу. Рівняння такої реакції виглядає наступним чином:З іншими оксидами
Крім того, розглядуваний оксид здатний реагувати з діоксидом карбону (вуглекислим газом). При цьому утворюється сіль - карбонат калію. Рівняння реакції оксиду калію та оксиду карбону можна записати наступним чином:Цю реакцію можна виразити таким рівнянням:

Взаємодія з кислотами
Найпоширеніший випадок - оксид калію + сірчана кислота = сульфат калію + вода. Рівняння реакції виглядає таким чином:До 2 Про галогени
Розглянуте хімічна сполука здатна реагувати і з речовинами цієї групи. До галогенам належать прості сполуки, що складаються з декількох атомів одного і того ж хімічного елемента. Це, наприклад, хлор, бром, йод і деякі інші. Отже, хлор і оксид калію: рівняння:Взаємодія з аміаком
До 2 Про здатний реагувати з цією речовиною. Внаслідок такого хімічного взаємодії утворюється гідроксид і амід калію. Рівняння даної реакції виглядає наступним чином:Взаємодія з органічними речовинами
З органічних хімічних речовин оксид калію взаємодіє з ефірами та спиртами. Однак ці реакції йдуть повільно і потребують спеціальних умов.Отримання До 2 Про
Дана хімічна речовина можна отримувати несолькими способами. Ось найпоширеніші з них:Використання До 2 Про в промисловості
Найбільш часто аналізоване речовина використовується в сільськогосподарській промисловості. Даний оксид є одним з компонентів мінеральних добрив. Калій дуже важливий для рослин, так як підвищує їх стійкість до різних захворювань. Також розглянуте речовина застосовується в будівництві, так як може бути в складі деяких видів цементу. Крім того, воно застосовується в хімічній промисловості для отримання інших сполук калію.Читайте також
НАУКА
Оксид азоту: формула, властивості, застосування
НАУКА
Гомогенні реакції: опис і приклади

НАУКА
Діоксид вуглецю: формула, властивості та області застосування

НАУКА
Алюміній сульфат та інші сполуки алюмінію в природі та житті людини

НАУКА
Солі амонію: властивості. Солі амонію: застосування
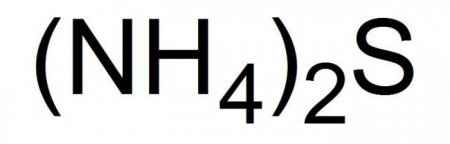
НАУКА
Сульфід амонію: отримання, гідроліз, застосування

НАУКА
Кисень: хімічні властивості елемента

НАУКА
Оксид барію: отримання і застосування