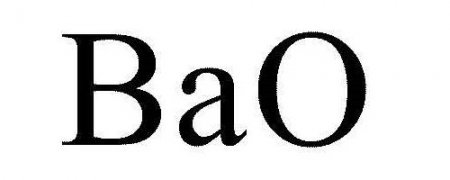Оксид барію: отримання і застосування
Різноманіття навколишнього світу не перестає дивувати людство. Дослідники відкривають перед нами нові горизонти, грунтуючись на отриманих результатах попереднього покоління. У цьому сенсі хімія – наука, яка не може бути повністю вивченою, сучасні технологічні рішення знаходять найбільш оптимальні і необхідні області застосування для вже пізнаних людством елементів. XIX століття стало часом відкриттів, XXI – періодом більш ефективного їх використання. Наприклад, оксид барію, - речовина, вивчене багатосторонньо, але хто знає, які нові технології будуть пов'язані з ним майбутньому.

Кальцінованням попередньо обложеного нітрату барію, яке відбувається з виділенням чистого кисню. 2Ba(NO 3 ) 2 = 2BaO + 4NO 2 + O 2 . Реакція взаємодії з киснем металевого барію. 2Ba + O 2 = 2BaO. Каталізатором служить температура 500-600 0 З, в цьому випадку не виключено одержання пероксиду. 2Ba + O 2 = 2BaO 2 . При подальшому нагріванні до 700 0 З речовина розпадається на вільний кисень і оксид барію. Для процесу розкладання карбонату барію на оксид і вуглекислий газ необхідно вплив високої температури. BaCO 3 = BaO + CO 2 . Для отримання більш чистого кінцевого речовини необхідно видалити надлишки углекислорода.
Взаємодія з водою відбувається досить бурхливо, з виділенням тепла і утворення лужного розчину. BaO + H 2 O = Ba(OH) 2 . З киснем оксид взаємодіє при наявності каталізатора (висока температура 600-500 0 З), результатом є пероксид, розкладаний надалі на складові частини для виділення чистого металу або оксиду. При цьому необхідно збільшити нагрівання до 700 0 С. 2Ba + O 2 = 2BaO 2 . Як типовий основний оксид барію взаємодіє з кислотами, в результаті хімічної реакції виходить вода і відповідна сіль. BaO + H 2 SO 4 = H 2O + BaSO 4 або BaO + 2HCI = H 2 O + BaCI 2. Кислотні оксиди вступають в реакцію з BaO, результатом взаємодії є солі. BaO + CO 2 = BaCO 3 або BaO + SO 3 = BaSO 4 . Для вивільнення чистого барію оксид прожарюють з металами, які забирають виділяється кисень. В якості таких виступають кремній, алюміній, цинк або магній.
Барій
Лужноземельний метал, який входить до складу земної кори привернув увагу хіміків в XVIII столітті. Перша згадка про це елементі пов'язано з його кисневим з'єднанням – оксидом барію. Він має дуже високу для свого виду щільність, тому отримав назву «важкий», яке в подальшому стало назвою самого елемента. Хімічно активний метал, тому для його отримання в чистому вигляді необхідно провести ряд реакцій у присутності каталізатора. Найбільш поширеним в природі мінералом, що містить барій, є його сульфат BaSO 4 (важкий шпат барит) і BaCO 3 (витерит). Саме з даними сполуками пов'язаний процес отримання такої речовини, як оксид барію. Надалі воно використовується для виділення металу в чистому вигляді і має власні напрямки застосування.Найважливіші сполуки
Як і всі типові метали, барій вступає в хімічну реакцію з киснем, при цьому отримане речовина залежить від умов процесу і каталізатора. Наприклад, проста реакція оксиду з водою дає можливість утворювати Ba(OH) 2 - гідроксид барію. Оксид барію отримують з нітрату. Типові з'єднання з усіма галогенами: BaF 2 , BaCI 2 , BaI 2 , BaS, BaBr 2 . Утворення нітратів, сульфідів, сульфатів, відбувається за рахунок взаємодії мінералів з відповідними кислотними розчинами. На сьогоднішній день всі найважливіші сполуки барію знаходять своє застосування. Але виключити нові відкриття у сфери використання даної речовини можна, з зростанням технологічності приладів його значення буде тільки зростати як на промисловому, так і на побутовому рівні.Оксиди
Бінарна зв'язок хімічного елемента з киснем найбільш поширена форма речовини в природі. При цьому оксиди утворюють метали і неметали. Саме характеристика елемента при взаємодії з киснем стала основою формування періодичної системи Менделєєва Д. І. Для металургійної галузі найбільш прийнятним способом виділення речовини є процес його отримання з оксиду. Попередньо металева природна руда (солі металів) піддається різним хімічним впливам, спрямованим на отримання окису. Як правило, даний процес супроводжується нагріванням до необхідної температури. Винятком не є і оксид барію. Формула отриманого речовини має вигляд: BaO. Оксиди можна отримати й іншими способами. Наприклад, гідроксидів, солей і самих оксидів більш високою ступені окислення.Оксид барію
Насамперед необхідно відзначити, що всі сполуки даного металу токсичні (виняток становить сульфат), тому потрібно дотримуватися елементарних правил безпеки при роботі. Це стосується багатьох хімічних елементів. Інша назва – барит безводний - не слід плутати з сульфатом, який є природним мінералом. У нормальних (стандартних) умовах білі кристали або порошок, іноді безбарвні з типовою ґратами кубічного виду, є поєднанням металу з киснем і називаються оксид барію. Формула речовини - BaO. Технічна модифікація оксиду може мати сірий колір, який йому надає вугілля, не повністю виведений з складу.
Фізичні властивості
Типове агрегатний стан оксиду тверде, щільність 572 (20 0 З), молярна маса – 15334 г/моль. З'єднання має досить високу теплопровідність 48-78 Вт/(мК)(80-1100К), і тугоплавкість температура кипіння – 2000 0 С, плавлення – 1920 0 С. Оксид барію був відкритий в 1774 році Шеєле Карлом Вільгельмом.Отримання
Існує кілька способів виділення такої речовини, як оксид барію. Застосовуються вони у відповідності з поставленою метою і кількістю одержуваного речовини. Для лабораторних і промислових умов підходять всі спобличчя, тому як отримати оксид барію вибирає виробник. Застосовувані методи:Хімічні властивості
Більшість бінарних сполук металу з киснем проявляють основні властивості. Рівняння оксиду барію (формула ВаО) показує, що дана речовина відноситься саме до таких окислів. При цьому дана сполука є солеобразующим. Типові хімічні взаємодії відбуваються з наступними класами речовин:Застосування
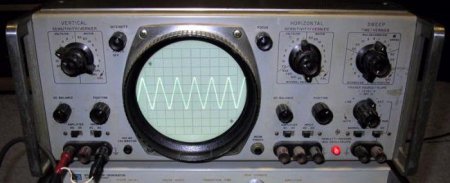
Барій та його сполуки дають дуже потужну яскравість кольору при покритті поверхні інших речовин. Тому оксиди марганцю і барію служать одиницями вимірювання коефіцієнта яскравості. Використовується для отримання зеленого кольору в піротехніці, при декоративній обробці в складі глазурей і емалей. Досить низька вартість обробки і отримання, високий рівень виділення тепла дає можливість використання оксиду в якості каталізатора при проведенні хімічних реакцій. Зокрема, дана речовина застосовується для виділення чистого металу (Ва), отримання гідроксиду та пероксиду. Виробництво кераміки, використовуваної при найбільш низьких температурах (рідкий азот), відбувається за участю оксиду барію. В процес синтезу включаються рідкоземельні метали і окис міді. Досить широкий спектр застосування речовини в приладобудуванні. Оксид барію використовується для покриття осцилографічних і телевізійних трубок, різних видів катодів, електронновакуумних виробів. Служить в якості активної маси для потужних акумуляторів медноокисного виду. Оксид барію є одним з основних елементів у складі скла, яке має досить специфічний напрямок застосування, використовується для покриття поверхні стрижнів з урану. Для створення оптичних стекол дана речовина так само незамінне.Читайте також

Поради
Що таке пігмент і де він використовується?
НАУКА
Оксид азоту: формула, властивості, застосування

НАУКА
Діоксид вуглецю: формула, властивості та області застосування

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Оксид та гідроксид кальцію
НАУКА
Сульфід амонію: отримання, гідроліз, застосування

НАУКА
Кисень: хімічні властивості елемента

НАУКА
Температура плавлення олова і свинцю