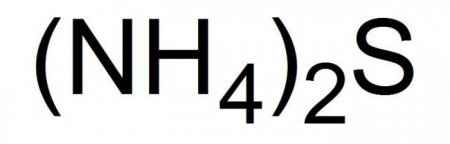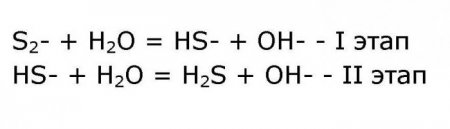Сульфід амонію: отримання, гідроліз, застосування
Азот - один з найважливіших елементів органічної хімії. У вигляді складних сполук елемент N є важливою частиною білків, з яких складаються всі живі організми на нашій планеті. Цей досить активний хімічний елемент утворює безліч сполук, одним з яких є з'єднання амонію.
іонне рівняння гідролізу за катиону:
NH 4 + +H 2 O = NH 3 *H 2 O + H+; рівняння гідролізу по аніону проходить у два етапи: Підсумкове іонне рівняння реакції виглядає наступним чином: NH4 + +S2- + 2H2O = NH3*H2O + HS- + H+ + OH-.
Стандартний запис хімічної реакції виглядає так: (NH 4 )2S + 2H 2 O = NH 3 *H 2 O + NH 4 HS + H 2 O. Без нагрівання реакція може бути оборотна і відбувається з першої сходинки. Але якщо речовина підігріти, реакція стане незворотною – кінцеві речовини аміак і сірководень просто покидають поле взаємодії і випаровуються.
NH 4 + + H 2 O NH 3 ·H 2 O + H +
S 2 - + H 2 O HS - + OH - Сульфід аміаку у воді розпадається на аміак і сірководень. Подальше розкладання супроводжується виділенням водню і появою розчиненого у воді аміаку і слабкого аніона HS - . Тому в таблицях, пояснювальних раствормость хімічних елементів, сульфід амонію позначений пропуском.
Ця речовина добре знайоме фотографам і текстильників. У фотографії це з'єднання використовується для обробки плівки. При взаємодії з сильними підставами відбувається хімічна реакція, що супроводжується виділенням шкідливих речовин. У текстильній промисловості сульфід амонію використовується як компонент відбілюючих сумішей. Металурги і реставратори успішно користуються ним для перетворення патини в бронзу. Сульфід амонію неодмінно використовується при виробництві сечовини, як важливого добрива, а також при виробництві соди. Можливо, застосування цієї речовини в господарській діяльності було б більш поширеним. Але з-за надзвичайної леткості цієї сполуки воно досить швидко вступає в хімічну реакцію з водяною парою, що містяться в повітрі. Кінцевим продуктом цього взаємодії є сірководень, який славиться своїм різким і дуже неприємним запахом. Саме ця особливість сульфіду амонію стала причиною його використання у виробництві продукції для розіграшів, включаючи «смердючі бомби» та інше.
Що це таке
В молекулі аміаку азот охоплює своїми ковалентними зв'язками три атома водню, причому остання електронна зв'язок залишається вільною. Таким чином, амоній може виступати донором різних хімічних реакцій, утворюючи четверту – незатраченную ковалентную зв'язок з іншими речовинами та сполуками. Якщо таке з'єднання відбувається з атомом водню, що утворюється молекула NH 4 . Отриманий елемент може реагувати з різними кислотами, які знаходяться в розчиненому або концентрованому вигляді. При взаємодії аміак їх нейтралізує. У результаті реакції утворюються солі амонію - термічно нестійкі сполуки. Якщо сіль амонію нагрівати, вона швидко розкладається на складові речовини. При підвищенні температури утворюється аміак з кислотою. Можливий і зворотний процес. Наприклад, при взаємодії з сірководневою кислотою можна отримати сульфід амонію.Формула
Це з'єднання записується в хімічних рівняннях в видеследующей формули. У вільному стані сульфід амонію являє собою кристали. Або голки жовтого кольору з низькою температурою плавлення. Друга назва з'єднання - сірчистий амоній. Це з'єднання легко отримати, але ще легше втратити – жовті кристали дуже летких і швидко розпадаються при нормальних умовах.Поширені хімічні реакції
Гідроліз сульфіду амонію відрізняється від інших подібних реакцій солей тим, що в ній беруть участь і катіони і аніони одного і того ж речовини. Процес реакції залежить від температури. Гідроліз сульфіду амонію може бути записаний наступним чином:NH 4 + +H 2 O = NH 3 *H 2 O + H+;
Стандартний запис хімічної реакції виглядає так:
Отримання сульфіду амонію
Сульфід амонію найчастіше отримують при взаємодії сірководню з надлишком аміаку: H 2 S + 2 NH 3 -> (NH 4 ) 2 S. Однією з найбільш характерних особливостей цього з'єднання є повне розкладання сполуки у воді. Ланцюг хімічної реакції виглядає наступним чином: (NH 4 ) 2 S -> 2NH 4 + + S 2 -NH 4 + + H 2 O NH 3 ·H 2 O + H +
S 2 - + H 2 O HS - + OH - Сульфід аміаку у воді розпадається на аміак і сірководень. Подальше розкладання супроводжується виділенням водню і появою розчиненого у воді аміаку і слабкого аніона HS - . Тому в таблицях, пояснювальних раствормость хімічних елементів, сульфід амонію позначений пропуском.
Практичне застосування
У промисловості практичне застосування розроблено для парів сульфіду амонію. Рідка форма цього з'єднання використовується при транспортуванні. Зберігають його в закритих, хімічно інертних ємностях.Ця речовина добре знайоме фотографам і текстильників. У фотографії це з'єднання використовується для обробки плівки. При взаємодії з сильними підставами відбувається хімічна реакція, що супроводжується виділенням шкідливих речовин. У текстильній промисловості сульфід амонію використовується як компонент відбілюючих сумішей. Металурги і реставратори успішно користуються ним для перетворення патини в бронзу. Сульфід амонію неодмінно використовується при виробництві сечовини, як важливого добрива, а також при виробництві соди. Можливо, застосування цієї речовини в господарській діяльності було б більш поширеним. Але з-за надзвичайної леткості цієї сполуки воно досить швидко вступає в хімічну реакцію з водяною парою, що містяться в повітрі. Кінцевим продуктом цього взаємодії є сірководень, який славиться своїм різким і дуже неприємним запахом. Саме ця особливість сульфіду амонію стала причиною його використання у виробництві продукції для розіграшів, включаючи «смердючі бомби» та інше.
Читайте також

НАУКА
Що таке каучук, його види

НАУКА
Солі вуглеамонійні: опис, склад, сфера застосування
НАУКА
Оксид азоту: формула, властивості, застосування
НАУКА
Ступінь окислення азоту в амонії

НАУКА
Ступінь і константа гідролізу

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Солі амонію: властивості. Солі амонію: застосування
НАУКА
Як розрахувати обсяг різних геометричних тіл?