Ступінь окислення азоту в амонії
Існують хімічні елементи, що виявляють різні ступені окислення, що дозволяє утворювати в ході хімічних реакцій велику кількість сполук з певними властивостями. Знаючи електронна будова атома, можна припустити, які речовини будуть утворюватися. Ступінь окислення азоту можуть варіюватись від -3 до +5 що вказує на різноманіття сполук на його основі.
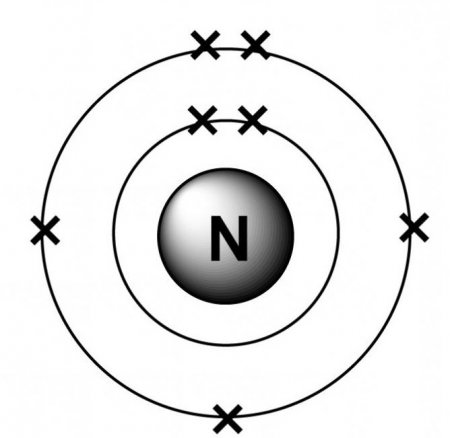
У природі зустрічається у вигляді двоатомних безбарвного газу атмосферного повітря з об'ємною часткою більше 75%. Міститься у складі білкових молекул, нуклеїнових кислот і азотовмісних речовин неорганічного походження.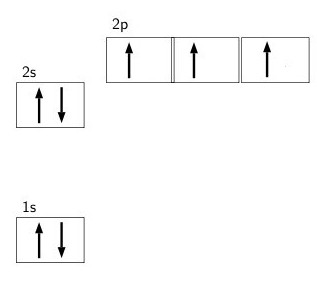 На другий зовнішній оболонці є всього п'ять негативно заряджених частинок: два на 2s-підрівні і три на 2p-орбитале. Валентний енергетичний рівень не має вільних комірок, що вказує на неможливість поділу його електронної пари. Орбіталь 2р вважається заповненої електронами тільки наполовину, що дозволяє приєднати 3 негативно заряджені частинки. В такому випадку ступінь окислення азоту дорівнює -3.
На другий зовнішній оболонці є всього п'ять негативно заряджених частинок: два на 2s-підрівні і три на 2p-орбитале. Валентний енергетичний рівень не має вільних комірок, що вказує на неможливість поділу його електронної пари. Орбіталь 2р вважається заповненої електронами тільки наполовину, що дозволяє приєднати 3 негативно заряджені частинки. В такому випадку ступінь окислення азоту дорівнює -3.
Враховуючи будову орбіталей, можна зробити висновок, що даний елемент з координаційним числом 4 максимально пов'язується тільки з чотирма іншими атомами. Для утворення трьох зв'язків використовується обмінний механізм, ще одна формується донорно-акцепторним способом.
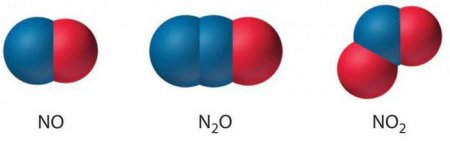
Існує ступінь окиснення -1 коли цей елемент отримує тільки 1 негативну частку. Наприклад, в NH 2 OH або гидроксиламине він заряджений негативно. Бувають позитивного знаку ступеня окислення азоту, коли з зовнішнього енергетичного шару забираються електронні частинки. Варіюють від +1 до +5. Заряд 1+ є у азоту N 2 O (одновалентном оксиді) і в гипонитрите натрію з формулою Na 2 N 2 O 2 . В NO (двухвалентном оксиді) елемент віддає два електрони і заряджається позитивно (+2). Існує ступінь окислення азоту 3 (в з'єднанні NaNO 2 або нітриду і ще в трехвалентном оксиді). У такому разі відщеплюється 3 електрона. Заряд +4 буває в оксиді з валентністю IV або його димере (N 2 O 4 ). Позитивний знак ступені окиснення (+5) проявляється в N 2 O 5 або в пятивалентном оксиді, азотної кислоти та її похідних солях.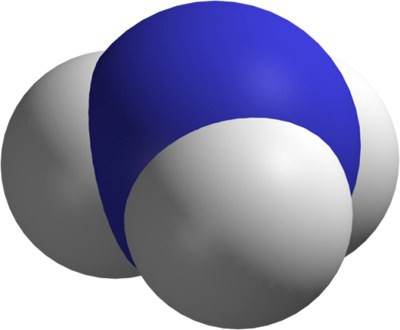 До найбільш значущих водневих сполук відносять молекули аміаку, гідразину та азотисто-водневої кислоти. Їх отримують шляхом взаємодії водню з азотом, а в останньому речовині присутній кисень.
До найбільш значущих водневих сполук відносять молекули аміаку, гідразину та азотисто-водневої кислоти. Їх отримують шляхом взаємодії водню з азотом, а в останньому речовині присутній кисень. 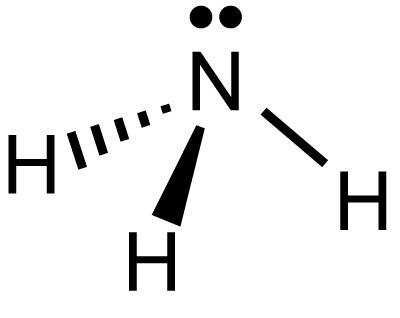
У даного елемента знаходиться ще неподеленная пара електронів на зовнішньому рівні, яка створює зв'язок ковалентную з іоном водню, що має позитивний заряд. Один елемент є донором негативно заряджених часток, а інший акцептором. Так утворюється амонійний іон NH 4 + .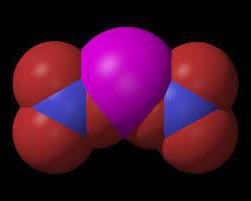 Якісною реакцією для виявлення іонів амонію є дія гідроксидів лужних металів на його сполуки. В присутність NH 4 + відбувається вивільнення аміаку.
Якісною реакцією для виявлення іонів амонію є дія гідроксидів лужних металів на його сполуки. В присутність NH 4 + відбувається вивільнення аміаку.  До таких сполук відносять нітриди магнію, літію, цинку або міді, за винятком лужних металів. Вони володіють високою температурою плавлення. До нітриду з проміжною зв'язком відносяться речовини, у яких розподілені рівномірно атоми металів і азоту і відсутнє чітке зміщення електронного хмари. До таким інертним сполук належать нітриди заліза, молібдену, марганцю і вольфраму .
До таких сполук відносять нітриди магнію, літію, цинку або міді, за винятком лужних металів. Вони володіють високою температурою плавлення. До нітриду з проміжною зв'язком відносяться речовини, у яких розподілені рівномірно атоми металів і азоту і відсутнє чітке зміщення електронного хмари. До таким інертним сполук належать нітриди заліза, молібдену, марганцю і вольфраму .
Характеристика елемента
Азот відноситься до хімічним елементам, розташованим в 15 групі, у другому періоді періодичної системи Менделєєва Д. І. Йому присвоєно порядковий номер 7 та скорочене літерне позначення N. У нормальних умовах порівняно інертний елемент, для проведення реакцій необхідні спеціальні умови.У природі зустрічається у вигляді двоатомних безбарвного газу атмосферного повітря з об'ємною часткою більше 75%. Міститься у складі білкових молекул, нуклеїнових кислот і азотовмісних речовин неорганічного походження.
Структура атома
Щоб визначити ступінь окислення азоту в сполуках, необхідно знати його ядерну структуру та вивчити електронні оболонки. Природний елемент представлений двома стійкими ізотопами, з числом їх маси 14 або 15. У першому ядрі міститься 7 нейтронових і 7 протонових частинок, а в другому – на 1 нейтроновую частку більше. Існують штучні різновиди його атома з масою 12-13 і 16-17 які мають нестабільними ядрами. При вивченні електронної структури атомарного азоту видно, що є дві електронні оболонки (внутрішня і зовнішня). На 1s-орбіталі міститься одна пара електронів.
Враховуючи будову орбіталей, можна зробити висновок, що даний елемент з координаційним числом 4 максимально пов'язується тільки з чотирма іншими атомами. Для утворення трьох зв'язків використовується обмінний механізм, ще одна формується донорно-акцепторним способом.
Ступінь окислення азоту в різних з'єднаннях
Максимальна кількість негативних частинок, який здатний приєднати його атом, дорівнює 3. У такому разі проявляється ступінь його окислення дорівнює -3 притаманна з'єднанням типу NH 3 або аміаку, NH 4 + або амонію і нітриду Me 3 N 2 . Останні речовини формуються при підвищенні температури шляхом взаємодії азоту з атомами металів. Найбільша кількість негативно заряджених частинок, яке здатний віддати елемент, прирівнюється до 5. Два атоми азоту здатні з'єднуватися між собою з утворенням стійких сполук зі ступенем окислення -2. Такий зв'язок спостерігається в N 2 H 4 або гидразинах, в азид різних металів або MeN 3 . Атом азоту приєднує на вільні орбіталі 2 електрона.Існує ступінь окиснення -1 коли цей елемент отримує тільки 1 негативну частку. Наприклад, в NH 2 OH або гидроксиламине він заряджений негативно. Бувають позитивного знаку ступеня окислення азоту, коли з зовнішнього енергетичного шару забираються електронні частинки. Варіюють від +1 до +5. Заряд 1+ є у азоту N 2 O (одновалентном оксиді) і в гипонитрите натрію з формулою Na 2 N 2 O 2 . В NO (двухвалентном оксиді) елемент віддає два електрони і заряджається позитивно (+2). Існує ступінь окислення азоту 3 (в з'єднанні NaNO 2 або нітриду і ще в трехвалентном оксиді). У такому разі відщеплюється 3 електрона. Заряд +4 буває в оксиді з валентністю IV або його димере (N 2 O 4 ). Позитивний знак ступені окиснення (+5) проявляється в N 2 O 5 або в пятивалентном оксиді, азотної кислоти та її похідних солях.
З'єднання з азоту з воднем
Природні речовини на основі двох вищевказаних елементів нагадують органічні вуглеводні. Тільки азотоводороди втрачають свою стійкість при збільшенні кількості атомарного азоту.
Що таке аміак
Його ще називають нітридом водню, а його хімічна формула позначається як NH 3 з масою 17. В умовах з нормальною температурою і тиском аміак має форму безбарвного газу з різким нашатирним запахом. По щільності він в 2 рази рідше повітря, легко розчиняється у водному середовищі за рахунок полярного будову його молекули. Відноситься до малонебезпечних речовин. У промислових обсягах аміак отримують з допомогою каталітичного синтезу з водневих і азотних молекул. Існують лабораторні методи отримання з амонійних солей та натрію нітриту.Будова аміаку
У складі молекули пірамідальної присутній один азот і 3 атома водню. Розташовані вони по відношенню один до одного під кутом 107 градусів. В молекулі, що має форму тетраедра, азот розташований по центру. За рахунок трьох неспарених p-електронів він з'єднується полярними зв'язками ковалентного природи з 3 атомарними водородами, у яких є по 1 s-електрона. Так утворюється аміачна молекула. В даному випадку азот проявляє ступінь окислення -3.
У даного елемента знаходиться ще неподеленная пара електронів на зовнішньому рівні, яка створює зв'язок ковалентную з іоном водню, що має позитивний заряд. Один елемент є донором негативно заряджених часток, а інший акцептором. Так утворюється амонійний іон NH 4 + .
Що таке амоній
Його відносять до позитивно заряджених полиатомним іонів або катіонів. Амоній ще зараховують до хімічних речовин, які не можуть існувати в формі молекули. Він складається з аміаку і водню. Амоній з позитивним зарядом в присутності різних аніонів з від'ємним знаком здатний утворювати амонійні солі, в яких веде себе подібно металами з валентністю I. Також за її участі синтезуються амонієві сполуки. Багато солі амонію існують у вигляді кристалічних безбарвних речовин, які добре розчиняються водою. Якщо з'єднання іона NH 4 + утворені леткими кислотами, то в умовах нагрівання відбувається їх розпад з виділенням газоподібних речовин. Подальше їх охолодження призводить до оборотного процесу. Стабільність таких солей залежить від сили кислот, з яких вони утворені. Стійкі сполуки амонію відповідають сильному кислотного залишку. Наприклад, стабільний амонію хлорид проводиться з соляної кислоти. При температурі до 25 градусів така сіль не розкладається, що не можна сказати про карбонате амонію. Останнє з'єднання часто використовується в кулінарії для підйому тесту, замінюючи харчову соду. Кондитери карбонат амонію називають просто амонієм. Таку сіль застосовують пивовари для поліпшення бродіння пивних дріжджів.
Хімічна структура амонію
Конфігурація його іона нагадує правильний тетраедр, по центру якого знаходиться азот. Атоми водню розташовані по вершинах фігури. Щоб розрахувати ступінь окислення азоту в амонії, потрібно пам'ятати, що загальний заряд катіона дорівнює +1 а у кожного іона водню відсутня по одному електрону, а їх всього 4. Сумарний водневий потенціал становить +4. Якщо з заряду катіона відняти заряд всіх іонів водню, то отримаємо: +1 - (+4) = -3. Отже, азот має ступінь окислення -3. В даному випадку він приєднує три електрона.Що таке нітриди
Азот здатний з'єднуватися з більш електроположительними атомами металевої та неметалевої природи. У результаті утворюються сполуки схожі з гідридами і карбідами. Такі азотовмісні речовини називають нітриди. Між металом і азотним атомом у з'єднаннях виділяють ковалентную, іонну і проміжну зв'язку. Саме така характеристика лежить в основі їх класифікації. До нітриду ковалентним відносять з'єднання, в хімічній зв'язку яких електрони не переходять від атомарного азоту, а утворюють разом з негативно зарядженими частками інших атомів загальне електронне хмара. Прикладом таких речовин є водневі нітриди, типу аміачних і гидразинових молекул, а також азотні галогеніди, до яких відносять трихлориди, трибромиди і трифториди. У них спільна електронна пара однаково належить двом атомам. До нітриду іонним відносять сполуки з хімічної зв'язком, утвореної переходом електронів від елемента металу на вільні рівні у азоту. В таких молекулах речовин спостерігається полярність. Нітриди мають ступінь окислення азоту 3-. Відповідно, загальний заряд металу буде 3+.
Опис оксиду тривалентного азоту
Його ще називають ангідридом, отриманими з азотистої кислоти, що має формулу HNO 2 . Враховуючи ступінь окислення азоту (3+) і кисню (2-) в триоксиде, виходить співвідношення атомів елементів 2 до 3 або N 2 O 3 . Рідка і газоподібна форма ангідриду - це досить нестійкі сполуки, вони легко розпадаються на 2 різних оксиду з валентністю IV і II.Читайте також

НАУКА
Що таке азот? Маса азоту. Молекула азоту
НАУКА
Оксид азоту: формула, властивості, застосування

НАУКА
Ступінь і константа гідролізу
НАУКА
Ковалентний полярний зв'язок: формула, властивості, особливості

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Солі амонію: властивості. Солі амонію: застосування
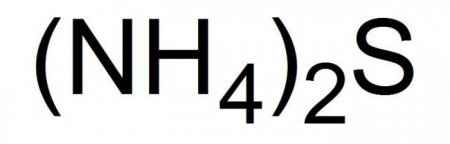
НАУКА
Сульфід амонію: отримання, гідроліз, застосування

НАУКА
Молекулярна маса: базові принципи визначення