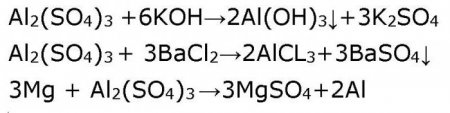Алюміній сульфат та інші сполуки алюмінію в природі та житті людини
У повсякденному житті кожен із нас щохвилини стикається з неймовірною кількістю хімічних речовин, як природних, так і створених самою людиною. Зупинимося на двох хімічних сполуках: сульфат алюмінію, гідроксид алюмінію. Що це таке і чому варто звернути на них увагу?
На відміну від сульфату алюмінію, гідроксид його являє собою біле тверда речовина, нерозчинна у воді. Алюміній сульфат, гідроксид алюмінію, каолініт широко поширені. Їх видобувають у Сибіру, Криму, Китаї, Японії, а також у країнах Центральної і Південної Америки.
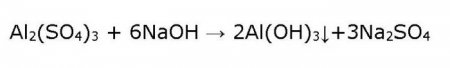
Розглядаючи взаємодію гідроксиду алюмінію Al(OH) 3 з лугами, будемо уважні і врахуємо умови, при яких відбувається реакція. Саме від них буде залежати кінцеві продукти: Сам же гідроксид Al(OH) 3 отримують у лабораторії непрямим шляхом, тобто не з оксиду і води, що в цьому випадку неможливо, а солі алюмінію. Для цього беруть розчин сульфату алюмінію і діють на нього лугом, наприклад їдким натром, обережно вливаючи його по краплях. В результаті в пробірці утворюється драглистий осад білого кольору – гідроксид Al(OH) 3 . Підсумовуючи все вище наведені реакції, доводять амфотерність гідроксиду алюмінію, зробимо висновок: в кислому середовищі хімічна рівновага зміщується в бік утворення солей Al, а в лужному – в бік утворення метаалюминатов або гидроксоалюминатов.
Можна було б продовжити заглиблюватися в приємні і хвилюючі для хіміка-естета подробиці даної теми, якщо б далеко не замаячило підозріло-скептичне особа з питанням: «Ну і що я з цього буду мати?»
Щоб познайомитися, потрібно заземлитися
Алюміній сульфат (глинозем) поряд з алюмосиликатами і різними видами глини становить основну масу земної кори. Це дозволяє алюмінію займати перше місце серед металів за поширеністю на Землі. У природі сульфат алюмінію, формула якого Al 2 (SO 4 )*18H 2 O, є кристаллогидратом і являє собою розчинні у воді кристали білого кольору з сірим, блакитним або рожевим відтінком.На відміну від сульфату алюмінію, гідроксид його являє собою біле тверда речовина, нерозчинна у воді. Алюміній сульфат, гідроксид алюмінію, каолініт широко поширені. Їх видобувають у Сибіру, Криму, Китаї, Японії, а також у країнах Центральної і Південної Америки.
Зри в пробірку
Щоб пізнати істину, визначимо, якими хімічними властивостями володіють сульфат і гідроксид Al. Перефразуємо крилатий вислів Козьми Пруткова «Дивися в корінь!» на більш прагматичне: «Зри в пробірку!» Почнемо з гідроксиду Al, представивши це речовина в образі дволикого Януса. Зовсім трохи хімічних сполук здатні одночасно реагувати і з кислотами, і з лугами. Така «дволикість» в хімії називається амфотерностью. Так, у реакціях гідроксиду алюмінію з кислотою отримуємо середні солі.Розглядаючи взаємодію гідроксиду алюмінію Al(OH) 3 з лугами, будемо уважні і врахуємо умови, при яких відбувається реакція. Саме від них буде залежати кінцеві продукти: Сам же гідроксид Al(OH) 3 отримують у лабораторії непрямим шляхом, тобто не з оксиду і води, що в цьому випадку неможливо, а солі алюмінію. Для цього беруть розчин сульфату алюмінію і діють на нього лугом, наприклад їдким натром, обережно вливаючи його по краплях. В результаті в пробірці утворюється драглистий осад білого кольору – гідроксид Al(OH) 3 . Підсумовуючи все вище наведені реакції, доводять амфотерність гідроксиду алюмінію, зробимо висновок: в кислому середовищі хімічна рівновага зміщується в бік утворення солей Al, а в лужному – в бік утворення метаалюминатов або гидроксоалюминатов.
Підтримує традиції
Відпочинемо від складнощів «дволикості» амфотерного гідроксиду алюмінію і звернемося до традиційної середньої солі – сульфату алюмінію. Ніяких відступів від правил. Розчини середніх солей реагують з лугами, кислотами, з іншими солями, з металами, що стоять у ряду Бекетова (ряд напруг металів) до металу, іон якого міститься в молекулі солі. Наприклад, алюміній сульфату в розчині буде реагувати з літієм, калієм, кальцієм, натрієм і магнієм. Підтвердимо це рівняннями реакцій. Сульфат алюмінію, формула якого Al 2 (SO 4 ) 3 є продуктом взаємодії слабкого підстави гідроксиду алюмінію Al(OH) 3 і сильної сульфатної кислоти H 2 SO 4 . Тому у водному розчині він легко гидролизирует. Надлишок іонів водню H + виявляється з допомогою індикатора лакмус, який змінює свій синій колір в розчині сульфату алюмінію на червоний. Таким чином, ми встановлюємо, що розчин сульфату алюмінію має кислу реакцію.Можна було б продовжити заглиблюватися в приємні і хвилюючі для хіміка-естета подробиці даної теми, якщо б далеко не замаячило підозріло-скептичне особа з питанням: «Ну і що я з цього буду мати?»
Вони прийдуть на допомогу
Щоб розвіяти всі сумніви, скажімо, що ви вже маєте масу корисних і навіть життєво необхідних речей, завдяки таких сполук, як алюміній сульфат, гідроксид алюмінію та інших алюминийсодержащим реагентів. В першу чергу Al(OH) 3 використовують для очищення жорсткої води. Після даного процесу вода стає прозорішою і світліше і звільняється від солей, роблять її жорсткою. У прагненні бути завжди красивими і доглянутими нам допомагають лосьйони, гелі, тоніки. Адже вони теж містять алюміній сульфат. Широко рекламована інновація в індустрії дезодорантів-антиперспірантів під назвою «кристали свіжості» – не що інше, як алюмокалиевие галун, компонентом яких є алюміній сульфат. Сполуки алюмінію мають обволікаючу здатність і тому використовуються у виробництві кольорових бавовняних тканин і фармакології.Читайте також

Поради
Де взяти магній: поради хіміку-любителю

Дім
Алюміній харчової і його сплав

Дім
Сульфат магнію: застосування, добриво квітів

НАУКА
Ступінь і константа гідролізу

НАУКА
Оксид калію: формула, взаємодія

НАУКА
Оксид та гідроксид кальцію

НАУКА
Солі амонію: властивості. Солі амонію: застосування

НАУКА
Оксид барію: отримання і застосування